
| 测定次数 | 收集前读数/mL | 收集后读数/mL |
| 第1次 | 21.06 | 4.24 |
| 第2次 | 23.52 | 6.72 |
| 第3次 | 22.41 | 5.63 |
| 第4次 | 20.80 | 7.20 |
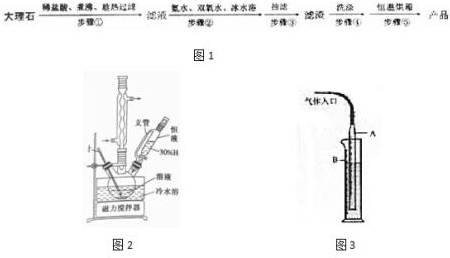
分析 由流程可知,碳酸钙溶于盐酸后,至溶液中尚存有少量固体,过滤后,滤液中氯化钙、氨水、过氧化氢反应生成CaO2、NH4Cl、水;再过滤,洗涤得到过氧化钙;制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品,石灰石便宜易得,但纯度较低,以此来解答,
(1)将溶液煮沸的作用是除去溶液中二氧化碳;
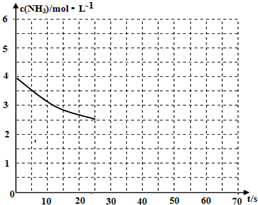
(2)反应②是滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体;过氧化氢热易分解,该反应需要在冰浴下、磁力搅拌、缓慢滴加H2O2溶液;
(3)步骤⑤恒温烘箱的目的是要将CaO2•8H2O分解成CaO2,同时又要注意防止温度过高使CaO2分解;
(4)硫酸与CaO2反应生成硫酸钙是微溶的物质,会使CaO2不能进一步反应;
(5)根据装置力可知仪器的名称,读取气体的体积时要注意先使气体冷却到室温,再将滴定管中的液面高度调整到与量筒内的液面在同一水平面上,再平衡视凹液面;
(6)根据图中数据可知,第1次的气体的体积为16.82mL,第2次的气体的体积为16.80mL,第3次的气体的体积为16.78mL,第4次的气体的体积为13.60mL,其中第四次与其它各次误差较大,应为绝对误差,应去掉,所以实验中收集到的气体的体积平均值为16.80mL,根据关系2CaO2~O2,由氧气的体积可计算出过氧化钙的含量.
解答 解:(1)步骤①的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,溶液中溶解二氧化碳,将溶液煮沸,趁热过滤,将溶液煮沸的作用是除去溶液中溶解的二氧化碳,
故答案为:除去溶液中溶解的二氧化碳;
(2)反应②是滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体,过氧化氢热易分解,该反应需要在冰浴下、磁力搅拌、缓慢滴加H2O2溶液,
故答案为:缓慢滴加H2O2溶液;
(3)步骤⑤恒温烘箱的目的是要将CaO2•8H2O分解成CaO2,同时又要注意防止温度过高使CaO2分解,所以温度应控制在120℃左右,
故答案为:使CaO2•8H2O分解成CaO2,同时又要注意防止温度过高使CaO2分解;
(4)硫酸与CaO2反应生成硫酸钙是微溶的物质,覆盖在CaO2的表面,会使CaO2不能进一步反应,
故答案为:硫酸与CaO2反应生成硫酸钙是微溶的物质,覆盖在CaO2的表面,阻止反应进行;
(5)根据装置图可知A 的仪器的名称为碱式滴定管,读取气体体积的具体方法是上下移动碱式滴定管,使碱式滴定管与量筒的液面相平,平视凹液面底部,分别读取加气体前后的滴定管的刻度,
故答案为:碱式滴定管;上下移动碱式滴定管,使碱式滴定管与量筒的液面相平,平视凹液面底部,分别读取加气体前后的滴定管的刻度;
(6)根据图中数据可知,第1次的气体的体积为16.82mL,第2次的气体的体积为16.80mL,第3次的气体的体积为16.78mL,第4次的气体的体积为13.60mL,其中第四次与其它各次误差较大,应为绝对误差,应去掉,所以实验中收集到的气体的体积平均值为16.80mL,根据关系2CaO2~O2可知,过氧化钙的质量为$\frac{16.8}{22.4}$×10-3×144g=0.1080g,过氧化钙的含量为$\frac{0.1080}{0.1350}$×100%=80%,
故答案为:80%.
点评 本题以过氧化钙的制备为载体考查了实验方案设计,重点考查了工艺流程的理解、对操作的分析评价、阅读获取信息的能力、化学计算等,准确获取题目中有用的信息进行利用是解本题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)△H<0.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 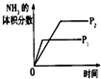 |  | 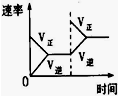 | 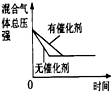 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ba2+、SO42-,Fe3+、K+ | B. | OH-、C1-、Na+ | ||
| C. | NH4+、NO3-、A13+、K+ | D. | HCO3-、SO42-、Na+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cs+、K+、Mg2+、Al3+ | B. | F、F-、Cl-、Br- | ||
| C. | Ca2+、K+、S2-、Cl- | D. | Al、Al3+、Mg、K |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com