
【题目】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
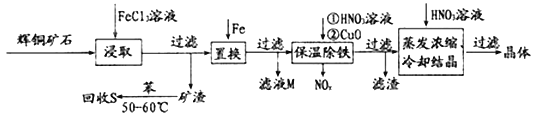
(1)“浸取”时,为了提高浸取速率可采取的措施有___________________________(任写一点)。写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:_____________________________________。
(2)“保温除铁”过程中,加入CuO的目的是_________________________________________;“蒸发浓缩、冷却结晶”过程中,加入HNO3调节溶液的pH,其理由是____________________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________________________。向“滤液M”中加入(或通入)_____ (填字母),可得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)“回收S”过程中温度控制在50 ~60℃之间,不宜过高或过低的原因是________________。
【答案】 粉碎矿石(搅拌等) Cu2S+4Fe3+==2Cu2++4Fe2++S 使Fe3+转化为Fe(OH)3而沉淀除去 抑制Cu2+的水解 4NOx+(5-2x)O2+2H2O==4HNO3 b 温度过高,苯易挥发;温度过低,矿渣的溶解速率小
【解析】辉铜矿主要成分为Cu2S,含少量SiO2等杂质,加入氯化铁浸取,过滤得到矿渣为SiO2、单质S,利用苯回收硫;滤液中含有Fe2+、Cu2+,加入铁粉置换出铜,过滤除去多余的铁,滤液为氯化亚铁溶液,滤渣为铜,通过加入氧化铜和硝酸溶液保温除铁,过滤后得到的滤液为硝酸铜,在硝酸的氛围中蒸发浓缩、冷却结晶后过滤得到硝酸铜晶体。(1)酸浸时,通过粉碎矿石或者升高温度或者进行搅拌都可以提高浸取率;“浸取”过程中Cu2S溶解时发生反应的离子方程式为Cu2S+4Fe3+==2Cu2++4Fe2++S;(2)“保温除铁”过程中,加入CuO的目的是使Fe3+转化为Fe(OH)3而沉淀除去;“蒸发浓缩、冷却结晶”过程中,加入HNO3调节溶液的pH,其理由是抑制Cu2+的水解;(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质硝酸,反应的化学方程式为4NOx+(5-2x)O2+2H2O==4HNO3。“滤液M”为氯化亚铁,向其中通入氯气反应后生成氯化铁也是可循环利用的物质。答案选b;(4)“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是温度过高,苯易挥发;温度过低,矿渣的溶解速率小。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)指出下图所表示的共价键名称,并列举含有该共价键的一种物质,写出其分子式。

共价键名称 举例
①__________,__________;
②__________,__________;
③__________,__________;
④__________,__________;
⑤__________,__________。
(2)某有机物分子的结构简式为CH2=CHCOOH,该分子中有________个σ键,________个π键,有__________种极性键,__________(填“有”或“没有”)非极性键。
(3)用电子式表示Cl2、NH3、H2S、CO2分子的形成过程________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置的叙述中,正确的是

A. 装置①不可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
C. 实验室可用装置③收集HCl
D. 验证溴乙烷发生消去反应生成烯烃的实验可利用装置④进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是
A.空气、天然气、苛性钾、石灰石B.液氯、氯水、硫酸钠、乙醇
C.盐酸、水煤气、醋酸、干冰D.胆矾、漂白粉、氯化钾、氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(沸点-89.7℃,还原性强)。某化学兴趣小组的同学用下述方法测定粮食中残留磷化物的含量。

在C中加入100g原粮,E中加入20.00mL 1.50×l0-3mol/L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)仪器D的名称是________________________。
(2)AlP与水反应的化学方程式为__________________________________。
(3)装置A中盛装KMnO4溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸( )的碱性溶液,其作用是_____________________________。
)的碱性溶液,其作用是_____________________________。
(4)通入空气的作用是____________________________________。
(5)装置E中PH3被氧化成磷酸,则装置E中发生反应的氧化剂和还原剂物质的量之比为______________。(6)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-4mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液15.00mL,Na2SO3与KMnO4溶液反应的离子方程式为______________, 则该原粮中磷化物(以PH3计)的含量为_____ mg·kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂,有多种组成,可表示为 Cua(OH)bClcxH2O。为测定某碱式氯化铜的 组成,进行下列实验:
(1)称取样品 1.1160g,用少量稀 HNO3 溶解后配成 100.00mL 溶液 A;
(2)取 25.00mL 溶液 A,加入足量 AgNO3 溶液,得 AgCl 0.1722g;
(3)另取 25.00mL 溶液 A,调节 pH 45,用浓度为 0.08000molL1 的 EDTA 标准溶液确定 A 中 Cu2+(原理为 Cu2++EDTA═EDTACu2+),消耗 EDTA 标准溶液 30.00mL。通过计算确定该样品的化学式( )
A. Cu2(OH)2Cl23H2O B. Cu2(OH)3ClH2O
C. Cu(OH)Cl2H2O D. Cu2(OH)Cl33H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,原子半径依次增大。W、X在同一主族,Y元素在第三周期中离子半径最小,Y和Z的原子序数之和是W的3倍。下列说法正确的是
A. X的简单氢化物的热稳定性比W的强 B. X的氧化物对应的水化物是强酸
C. Z和W形成的化合物可能含有非极性键 D. Z、Y的氧化物是常用的耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为某同学设计的检验浓硫酸和碳反应所得气体产物的实验装置图。下列说法正确的是

A. 若按①→③→②顺序连接,可检验所有气体产物
B. 若装置②只保留a、b,同样可以达到实验目的
C. 若圆底绕瓶内碳粉过量,充分反应后恢复到25℃,溶液的pH≥5.6
D. 实验结束后,应按从下往上、从左往右的顺序拆卸装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com