
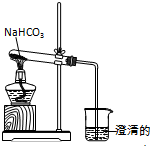
 实验室利用图所示装置进行NaHCO3的受热分解实验.
实验室利用图所示装置进行NaHCO3的受热分解实验.分析 NaHCO3不稳定,加热易分解,发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,生成的CO2会使澄清石灰水变浑浊,实验时注意防止倒吸,以此解答该题.
解答 解:(1)NaHCO3不稳定,加热分解生成的CO2会使澄清石灰水变浑浊,可观察到烧杯中国有气泡冒出,且有生成白色沉淀,
故答案为:有气泡冒出,溶液变浑浊;
(2)如先撤酒精灯,温度降低,试管内压强减小,会导致倒吸而使试管炸裂,应先将导管从溶液中移出,再熄灭酒精灯,所以操作①正确,
故答案为:①;倒吸,试管破裂;
(3)NaHCO3不稳定,加热分解生成的CO2、H2O和Na2CO3,反应的方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O.
点评 本题考查碳酸氢钠的性质,为高频考点,侧重于学生的分析、实验能力的考查,题目难度不大,本题要特别注意化学实验的安全操作问题,学习中注意相关基础知识的积累.


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 白醋中滴入石蕊试液呈红色 | B. | 白醋中c(H+)=0.01 moL/L | ||
| C. | 蛋壳浸泡在白醋中有气体放出 | D. | 白醋加入豆浆中有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
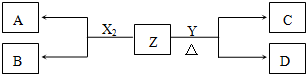
 ,D的水溶液pH>7(填“=”、“>”或“<”.
,D的水溶液pH>7(填“=”、“>”或“<”.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 李比希燃烧法、钠熔法、铜丝燃烧法都是用来分析有机物元素组成的方法 | |
| B. | 红外光谱法、紫外光谱法、核磁共振、质谱仪等都是现代化学测定有机物结构的常用方法 | |
| C. | 同位素示踪法是研究化学反应历程的手段之一 | |
| D. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR 谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR 来鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 含 T 的盐溶液一定显酸性 | |
| C. | 原子半径:T>Q>R | |
| D. | 最高价氧化物对应水化物的酸性:Q<W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com