
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是( )

A. L2+与R2﹣的核外电子数相等
B. M与T形成的化合物既能与强酸反应又能与强碱反应
C. 氢化物的稳定性为H2T<H2R
D. 单质与浓度相等的稀盐酸反应的速率为Q>L
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:实验题
乙醛在氧化铜催化下,可以被空气氧化成乙酸。依据此原理设计验证实验(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水用于收集少量乙酸溶液;烧杯B中装有某液体)。已知在60℃~80℃时,用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:

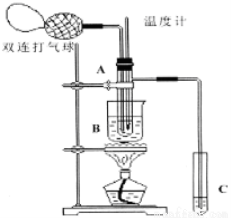
请回答下列问题:
(1)试管A内在60~80℃时发生的主要反应的化学方程式为(注明反应条件) ;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在 ;目的是 ;当试管A内的主要反应完成后温度计水银球的位置应在 ,目的是 ;
(3)烧杯B的作用是 ;烧杯B内盛装的液体可以是 或 (在上表中物质里选择,填写结构简式);
(4)若想检验试管C中是否含有产物乙酸,请你在下列药品中进行选择,设计一个简便的实验方法。可供选择的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末。实验仪器任选。该方法为________ ;
(5)已知乙醛能被溴水氧化,写出该反应的化学方程式______________________________ .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:实验题
海洋资源的利用具有广阔前景.
(1)如图是从海水中提取镁的简单流程。
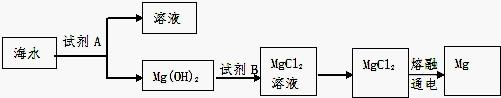
①工业上常用于沉淀Mg2+的试剂A是 ,Mg(OH)2转化为MgCl2的离子方程式是 。
②由无水MgCl2制取Mg的化学方程式是 。
(2)海带灰中富含以I﹣形式存在的碘元素.实验室提取I2的途径如下所示:
干海带 海带灰
海带灰 滤液
滤液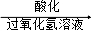
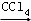
 I2
I2
①灼烧海带至灰烬时所用的主要仪器名称是 。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式 。
③反应结束后,加入CCl4作萃取剂,采用萃取﹣分液的方法从碘水中提取碘,主要操作步骤如图:
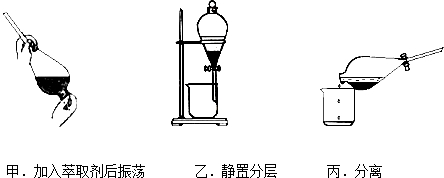
甲、乙、丙3步实验操作中,不正确的是 (填“甲”、“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:选择题
镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低等特点.一般研究的镁燃料电池可分为镁空气燃料电池、镁海 水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池.其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
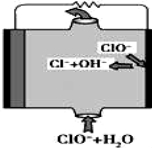
A.镁燃料电池中镁均为负极,发生氧化反应
B.镁次氯酸盐燃料电池的总反应式为:Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣
C.镁过氧化氢燃料电池,酸性电解质中正极反应式为:H2O2+2H++2e﹣═2H2O
D.镁次氯酸盐燃料放电过程中OH﹣移向正极
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末理科化学A卷(解析版) 题型:选择题
反应A+B→C(放热)分两步进行:①A+B→X(吸热),②X→C(放热).下列示意图中,能正确表示总反应过程中能量变化的是( )
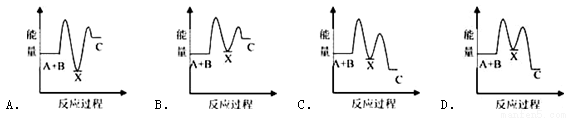
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三下热身考理综化学试卷(解析版) 题型:实验题
钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
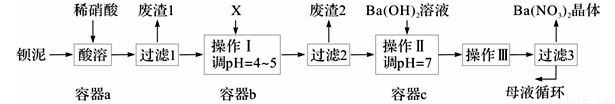
已知:i .Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii .Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii. Kap(BaSO4)=1.1×10-10,Ksp(BaCO3)=5.1×10-9。
(1)Ba(FeO2)2中Fe的化合价是 。
(2)二氧化碳与水作用形成的碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式 。
(3)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理: 。
(4)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(5)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(6)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(7)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三下热身考理综化学试卷(解析版) 题型:选择题
化学与生活、社会发展息息相关,下列有关说法不正确的是
A.古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
B.某种验钞笔中含有碘酒溶液,遇假钞呈现蓝色,其中遇碘变蓝的是葡萄糖
C.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D. 制造新版人民币所用的棉花、优质针叶木等原料的主要成分是纤维素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二下第二次月考化学试卷(解析版) 题型:选择题
某醇C5H11OH发生消去反应时,可以得到两种烯烃,又可发生催化氧化,则该醇的结构式可能为

查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二5月月考化学试卷(解析版) 题型:填空题
新型储氢材料是开发利用氢能的重要研究方向。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Cl原子中,价电子的电子排布式_________________,价电子所在电子层的轨道数______;
②LiBH4由Li+和BH4-构成,BH4-的空间构型是___________,B原子的杂化轨道类型是______;
③Li、B、Cl元素的电负性由大到小排列顺序为______________;
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径:Li+________H-(填“>”、“=”或“<”)。
②某储氢材料是短周期金属元素M的氢化物.M的部分电离能如下表所示:

M是_______(填元素符号);
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞边长a=480pm,Na+半径为104pm,H-的半径________pm,NaH的理论密度是_______________g•cm-3。(用NA表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com