
一定温度下,在2 L的密闭容器中发生如下反应:A(s)+2B(g) xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
xC(g) ΔH<0,B、C的物质的量随时间变化的关系如图1,达平衡后在t1、t2、t3、t4时都只改变了一种条件,逆反应速率随时间变化的关系如图2。
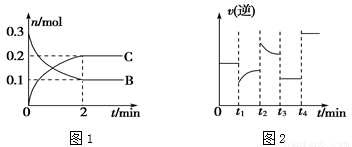
下列有关说法正确的是( )
A.x=2,反应开始2 min内,v(B)=0.1 mol/(L·min)
B.t1时改变的条件是降温,平衡逆向移动
C.t2时改变的条件可能是增大c(C),平衡时B的物质的量分数增大
D.t3时可能是减小压强,平衡不移动;t4时可能是使用催化剂,c(B)不变
科目:高中化学 来源:2017届四川省高三12月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.常温下,56 g铁片投入足量浓H2SO4溶液中生成NA个SO2分子
B.1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.50℃时,1.0 L pH=1的H2SO4 溶液中含有的H+数目为0.1NA
D.标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上学期阶段考二化学试卷(解析版) 题型:选择题
化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
A.“无磷洗涤剂”的推广使用,不能有效减少水体富营养化的发生
B.高纯度的单质硅被广泛用于制作光导纤维
C. PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
D.硫的氧化物和氮的氧化物是形成酸雨的主要物质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省湖州市高二上期中化学试卷(解析版) 题型:选择题
COCl2(g) CO(g)+Cl2(g) △H >0,达到平衡时,下列措施能提高COCl2转化率的是( )
CO(g)+Cl2(g) △H >0,达到平衡时,下列措施能提高COCl2转化率的是( )
A.恒容通入COCl2(g) B.使用催化剂 C.降低温度 D.恒压通入He
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:实验题
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
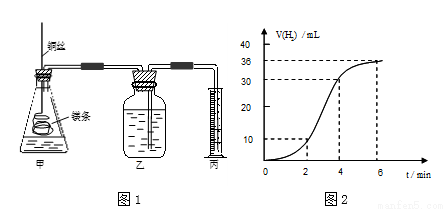
⑴取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3的方框中画出上述反应的速率与时间的关系曲线。

②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后 ,反应速率逐渐减慢,请简述其原_____________________________。
,反应速率逐渐减慢,请简述其原_____________________________。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO2- 4对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO2- 4对反应具有阻碍作用;
原因Ⅲ:______________________________;
原因Ⅳ:Cl-、SO2- 4均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:_____________________________。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化。
若观察到实验a中_____________,实验b中_________________,则说明原因Ⅰ是正确的。依次类推。该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
工业上合成氨反应的能量变化如图所示,该反应的热化学方程式是( )
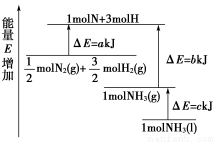
A.N2(g)+3H2(g)=2NH3(l) ΔH=2(a-b-c) kJ·mol-1
B.N2(g)+3H2(g)=2NH3(g) ΔH=2(b-a) kJ·mol-1
C.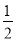 N2(g)+
N2(g)+ H2(g)=NH3(l) ΔH=(b+c-a) kJ·mol-1
H2(g)=NH3(l) ΔH=(b+c-a) kJ·mol-1
D.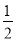 N2(g)+
N2(g)+ H2(g)=NH3(g) ΔH=(a+b) kJ·mol-1
H2(g)=NH3(g) ΔH=(a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省慈溪市高二上学期期中化学试卷(解析版) 题型:选择题
已知:CaCO3( s)=CaO(s)+CO2(g)则该反应能自发进行的条件是( )
s)=CaO(s)+CO2(g)则该反应能自发进行的条件是( )
A.低温 B.高温
C.任何温度下都能自发进行 D.任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
下列有关问题,与盐的水解无关的是( )
A.NH4Cl 与 ZnCl2 溶液可作焊接金属中的除锈剂
B.用 NaHSO4 去除暖手瓶中的水垢
C.实验室盛放 Na2CO3 溶液的试剂瓶不能用磨口玻璃塞
D.加热蒸干 AlCl3 溶液得到 Al(OH)3 固体
查看答案和解析>>
科目:高中化学 来源:2017届四川省成都市高三上学期一诊化学试卷(解析版) 题型:填空题
CO是合成尿素、甲酸的原料。
(1)在l00kPa和TK下,由稳定单质生成1mol化合物的焓变称为该物质在TK时的标准摩尔生成焓,用符号△H0表示。已知石墨和一氧化碳的燃烧热分别为393.5kJ/mol和283.0 kJ/mol,则CO(g)的△H0=________。
(2)合成尿素的反应:2NH3(g)+CO (g)=CO(NH2)2(g)+H2(g) △H = - 81.0kJ/mol;T℃时,在体积为2L的恒容密闭容器中,将2 mol的NH3和1mol CO混合反应,5 min时,NH3的转化率为80%。则0—5min平均反应速率为v(CO)= 。

则:K1 126.5(填“>”或“< ”);其判断理由是 。若保持恒温恒容条件,将物质的量之和为3 mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:
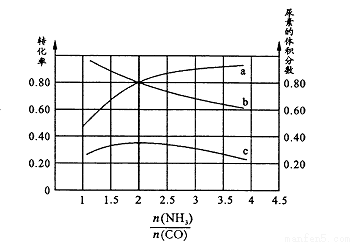
若图中c表示平衡体系中尿素的体积分数,则a表示________的转化率。
②当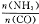 = 时,尿素含量最大;此时,对于该反虚既能增大正反应速率又能使平衡正向移动的措施是 (写一种)。
= 时,尿素含量最大;此时,对于该反虚既能增大正反应速率又能使平衡正向移动的措施是 (写一种)。
(3)通过人工光合作用可将CO转化成HCOOH。已知常温下,浓度均为0.1 mol/L的HCOOH和HCOONa混合溶液pH =3.7,则HCOOH的电离常数Ka= (已知lg2=0.3)。用电化学可消除HCOOH对水质造成的污染,其原理是电解CoSO4、稀硫酸和HCOOH混合溶液,用电解产生的Co3+将HCOOH氧化成CO2。
①Co3+氧化HCOOH的离子方程式为 ;
②忽略体积变化,电解前后Co2+的浓度将 (填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com