
(10分)霞石是一种硅酸盐,其组成可表示为K2O·3Na2O·4Al2O3·8SiO2,某小组同学设计以霞石为原料制备Al2O3的方案如下:
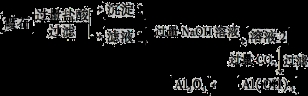
请回答下列问题:
(1)沉淀1的主要成分的化学式为 。
(2)向滤液1中加入过量NaOH溶液的有关反应离子方程式为 。
(3)由溶液2生成Al(OH)3的离子方程式为 。
(4)某同学提出上述流程较繁琐,可简化流程,其方法是向滤液1中加入足量的试剂X即可得到Al(OH)3,则试剂X为 。
(1) SiO2 (2分)
(2)H++OH- = H2O (2分) Al3++4OH- = AlO2-+2H2O (2分)
或答Al3++3OH- = Al(OH)3↓ ,Al(OH)3+OH- = AlO2-+2H2O
(3)AlO2-+CO2+2H2O = Al(OH)3↓+HCO3- (2分) (4) 氨水 (2分)
【解析】
试题分析:霞石(K2O·3Na2O·4Al2O3·8SiO2)加入过量盐酸后SiO2不溶转化为沉淀1,其他成分转化为KCl、NaCl、AlCl3、以及过量的盐酸存在滤液1中,滤液1加入过量NaOH溶液后溶液2的成分为KCl、NaCl、NaAlO2、以及过量的NaOH,再通入过量CO2时,生成Al(OH)3沉淀,Al(OH)3受热分解生成Al2O3。(1) 沉淀1的主要成分的化学式为SiO2;(2) 向滤液1中能与过量NaOH反应的物质有AlCl3和盐酸,有关反应离子方程式为:H++OH- = H2O 、Al3++4OH- = AlO2-+2H2O(或Al3++3OH- = Al(OH)3↓ ,Al(OH)3+OH- = AlO2-+2H2O);(3) 过量CO2与溶液2中的NaAlO2反应生成Al(OH)3的离子方程式为:AlO2-+CO2+2H2O = Al(OH)3↓+HCO3-;(4) Al(OH)3可溶于强碱但不溶于弱碱氨水,向滤液1中加入过量的NaOH溶液产生NaAlO2再通入过量CO2产生Al(OH)3,流程繁琐且试剂用量多,若用氨水代替,过量的氨水直接将滤液1中的AlCl3转化为Al(OH)3,故X为氨水。
考点:考查铝的化合物的性质。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源:2014-2015湖北省荆门市高一上学期期末考试化学试卷(解析版) 题型:选择题
有200mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)为0.2mol/L,c(Cl-)为1.3mol/L,欲将Mg2+、Al3+恰好转化为沉淀,需加入4mol/LNaOH溶液
A.65mL B.40mL C.72mL D.128mL
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省邯郸市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列气体中既可用浓硫酸干燥,又可用固体氢氧化钠干燥的是
A.NH3 B.H2 C.Cl2 D.SO2
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(AgBr)=7.7×10-13,则下列难溶盐的
饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI> AgBr B.AgCl> AgBr>AgI
C.AgBr >AgCl>AgI D.AgBr >AgI>AgCl
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列说法中可以说明密闭容器中的反应:P(g)+Q(g) R(g)+S(g)在恒温下已达平衡状态的是
R(g)+S(g)在恒温下已达平衡状态的是
A.反应容器内压强不随时间而变化
B.P和S的生成速率相等
C.反应容器内P、Q、R、S四者共存
D.反应容器内总物质的量不随时间而变化
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省湛江市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.氢氧化钠与氯化铜溶液:2OH-+Cu2+===Cu(OH)2↓
B.石灰石与盐酸:CO32-+2H+===CO2↑+H2O
C.氯气与碘化钾溶液:Cl2+2 I- = 2 I + 2 Cl-
D.用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-===2AlO2-+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省湛江市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列现象与胶体无关的是
A.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
B.明矾净水
C.将某些胶态金属氧化物分散于玻璃中制成有色玻璃
D.清晨,人们经常看到阳光穿过茂密的树木枝叶所产生的美丽“光柱”
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省湛江市高二第一学期期末化学试卷(解析版) 题型:选择题
已知常温下:Ksp(AgCl)=1.8×10-10 mol2·L-2,Ksp(Ag2CrO4)=1.9×10-12 mol3·L-3,
下列叙述正确的是
A.AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小
B.向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr)
C.将0.001 mol·L-1 的AgNO3溶液滴入0.001 mol·L-1的KCl 和0.001 mol·L-1的K2CrO4溶液中先产生Ag2CrO4沉淀
D.向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省龙岩市非一级达标校高一上学期期末化学试卷(解析版) 题型:选择题
下列反应的离子方程式不正确的是
A.用盐酸清除水垢CaCO3+2H+ = Ca2++CO2↑+H2O
B.Fe跟稀硫酸反应:Fe+2H+=Fe3++H2↑
C.澄清石灰水跟稀盐酸: H++OH- = H2O
D.碳酸氢钠溶液跟氢氧化钠溶液反应 HCO3-+OH-=H2O+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com