
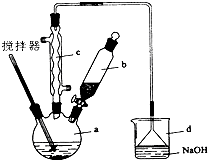
 在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:
在实验室中某实验小组同学关于硫酸铜的制取和应用,设计了以下实验:分析 (1)①铜与浓硫酸在加热条件下生成硫酸铜、二氧化硫和水;
②根据装置图可知,导管B可以平衡试管内外的压强,同时若C的导管堵塞时防止装置爆炸,另外拆除装置前从B管口向A鼓气使二氧化硫被全部吸收;
(2)高温灼烧固体应在坩埚中进行,从硫酸铜溶液中得到硫酸铜晶体可以将硫酸铜溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即可得到产品CuSO4•5H2O晶体,CuSO4•5H2O晶体中的结晶水容易失去,所以干燥需要控制温度小于100℃;
(3)向反应液中加少量FeSO4作催化剂时,氧气能将亚铁离子氧化成铁离子,铁离子与铜反应生成铜离子和亚铁离子;
(4)CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,据此分析计算即可;
解答 解:(1)①铜与浓硫酸在加热条件下生成硫酸铜、二氧化硫和水,反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
②根据装置图可知,导管B可以平衡试管内外的压强,同时若C的导管堵塞时防止装置爆炸,另外拆除装置前从B管口向A鼓气使二氧化硫被全部吸收,
故答案为:平衡试管内外的压强、若C的导管堵塞时防止装置爆炸、拆除装置前从B管口向A鼓气使二氧化硫被全部吸收;
(2)高温灼烧固体应在坩埚中进行,从硫酸铜溶液中得到硫酸铜晶体可以将硫酸铜溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即可得到产品CuSO4•5H2O晶体,CuSO4•5H2O晶体中的结晶水容易失去,所以干燥需要控制温度小于100℃,
故答案为:坩埚;蒸发浓缩、冷却结晶;CuSO4•5H2O失去部分结晶水;
(3)向反应液中加少量FeSO4作催化剂时,氧气能将亚铁离子氧化成铁离子,铁离子与铜反应生成铜离子和亚铁离子,其第l步反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,
故答案为:4Fe2++O2+4H+═4Fe3++2H2O;
(4)CuH溶解在稀盐酸中,CuH中的H-失电子,盐酸中H+得电子,所以得到的气体是H2,在此反应中CuH中Cu+在酸性条件下发生反应2Cu+=Cu2++Cu,H的化合价由-1价升高到0价,反应的方程工业2CuH+2HCl=CuCl2+Cu+2H2↑,已知生成气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,故依据方程式得出转移电子数为0.5mol,
故答案为:H2;0.5mol.
点评 本题是信息给予题,筛选有用信息结合已学知识进行整合处理,主要是铜及其化合物性质的分析应用,掌握基础是关键,题目难度中等.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z为0.3 mol/L | B. | Y2为0.1 mol/L | C. | X2为0.2 mol/L | D. | Z为0.35mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一组探究氯气性质的装置.
如图是一组探究氯气性质的装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,浓度均为0.2mol•L-1的NaHCO3和Na2CO3溶液中,都存在电离平衡和水解平衡,分别加入NaOH固体恢复到原来的温度,c(CO32- )均增大 | |
| B. | 已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol•L-1的NaA和NaB混合溶液中,c(Na+)>c(B-)>c(A-)>c( OH-)>c(HA)>c(HB)>c(H+) | |
| C. | pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液,其浓度:c(CH3COONa)>c(C6H5ONa)>c( Na2CO3)>c(NaOH) | |
| D. | 一定温度下,pH相同的溶液,由水电离产生的c(H+)相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备苯乙酮的化学方程式为:
实验室制备苯乙酮的化学方程式为: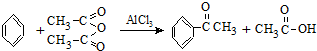
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
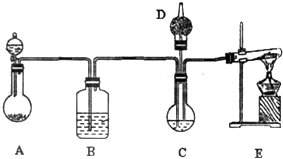 纳米碳酸钙有广泛的应用前景.用下图所示装置,在浓CaCl2溶液中通入NH3和CO2可制得纳米级碳酸钙.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
纳米碳酸钙有广泛的应用前景.用下图所示装置,在浓CaCl2溶液中通入NH3和CO2可制得纳米级碳酸钙.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com