
 (1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.
(1)向四个体积相同的密闭容器中分别充入一定量的SO2和O2,开始反应时,按正反应速率由大到小顺序排列为乙甲丁丙.分析 (1)温度越高、浓度越大、使用催化剂均可加快反应速率;
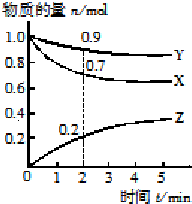
(2)根据图象可知X、Y的量减少是反应物;根据物质的量的变化与化学计量数呈正比书写化学方程式;反应开始至2min,Z的物质的量为0.2mol,以此计算反应速率;
(3)①根据速率之比等于化学计量数之比,结合v(HI),计算v(H2);
根据碘化氢的浓度计算I2的浓度变化量,5min时I2的浓度加I2的浓度变化量等于I2的起始浓度.开始等氢气和碘蒸气的物质的量相等,所以起始浓度相等;
②化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化.
解答 解:(1)由温度可知,丙中反应速率最慢;
温度相同时,乙中使用催化剂,则反应速率最快,
甲与丁比较,甲中浓度大,反应速率快,则按反应速率由大到小的排列顺序为乙、甲、丁、丙,
故答案为:乙甲丁丙;
(2)由图可知,X、Y反应物的物质的量减小,为反应物,Z的物质的量增加,Z为生成物,最后X、Y的物质的量为定值且不为0,说明是可逆反应,Y、Z、X的物质的量变化量之比为(1.0-0.9)mol:(1.0-0.7)mol:0.2mol=1:3:2,物质的量变化量之比等于化学计量数之比,所以反应方程式为:Y+3X?2Z,
反应开始至2min,Z的平均反应速率为$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:3X+Y?2Z; 0.05mol/(L•min);
(3)①v(HI)=$\frac{0.5mol/L}{5min}$=0.1mol/(L•min );
根据速率之比等于化学计量数之比,所以v(H2)=$\frac{1}{2}$v(HI)=$\frac{1}{2}$×0.1mol/(L•min )=0.05mol/(L•min );
I2的浓度变化量△c(I2)=$\frac{1}{2}$△c(HI)=$\frac{1}{2}$×0.5mol/L=0.25mol/L.
所以I2的起始浓度c(I2)=0.25mol/L+0.25mol/L=0.5mol/L.
开始等氢气和碘蒸气的物质的量相等,所以二者起始浓度相等.
所以氢气的起始浓度为0.5mol/L.
故答案为:0.1 mol/(L•min);0.05 mol/(L•min);0.5 mol/L;
②化学反应达到化学平衡状态时,各物质的浓度不再发生变化,所以平衡浓度C(HI)、C(I2)、C(H2)均为恒量,因未给出平衡常数等数据,不能判断浓度的具体关系,
故答案为:均为衡量.
点评 本题考查化学平衡图象分析题目,为高频考点和常见题型,题目难度不大,注意分析各物质的量的变化曲线,把握化学方程式的判断方法,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.075mol/L | B. | 0.1125mol/L | C. | 0.15mol/L | D. | 0.225mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).
亚硝酰氯(ClNO)是有机合成中的重要试剂,可由NO于Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2(g)?2ClNO(g).| 化学键 | N=O | Cl-Cl | Cl-N | N-O |
| 键能/(kJ•mol-1) | 630 | 243 | a | 607 |
| 序号 | c(ClNO)/mol•L-1 | v/mol•L-1•s-1 |
| ① | 0.30 | 3.6×10-8 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 解释或结论 |
| A | Fe(OH )3 胶体通电后 | 阴极区红褐色加深 | Fe(OH)3胶体带正电 |
| B | Al箔插入稀HNO3中 | 无现象 | Al箔表面被稀HNO3 氧化,形成致密的氧化膜 |
| C | 将过量的过氧化钠投入 滴有酚酞试液的水中 | 最终得红色溶液 | 过氧化钠与水反应生成碱性物质 |
| D | 将镁粉和铝粉的混合物加 入过量的烧碱溶液中 | 仍有未溶解粉末 | 铝粉能与烧碱溶液反应,而镁粉不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯储存在钢瓶中 | B. | 液溴装入试剂瓶中应加少量水液封 | ||
| C. | 固体碘保存在CCl4中 | D. | 氢氟酸盛放在塑料瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12、2.5 | B. | 24、2.5 | C. | 12、3 | D. | 24、3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com