
| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
分析 (1)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
②计算各气体的平衡浓度,代入平衡常数表达式计算;由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
③根据平衡移动原理分析解答,
a.增大c(NO),相当于增大压强,该反应前后气体的物质的量不变,平衡不移动;
b.该反应前后气体的物质的量不变,增大压强,平衡不移动;
c.反应移动存在热效应,升高温度,平衡一定移动;
d.移去部分生成物F,平衡向正反应移动;
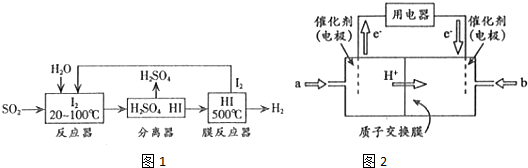
(2)①反应器中二氧化硫、碘发生氧化还原反应生成硫酸和HI;
②HI分解反应为可逆反应;
(3)根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应.
解答 解:(1)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C+2NO?N2+CO2,故答案为:C+2NO?N2+CO2;
②从C+2NO?N2+CO2,则该反应的平衡常数表达式为K=$\frac{{c({N_2})•c(C{O_2})}}{{c{{(NO)}^2}}}$,由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:$\frac{{c({N_2})•c(C{O_2})}}{{c{{(NO)}^2}}}$;C;
③a.增大c(NO),相当于增大压强,该反应前后气体的物质的量不变,平衡不移动,NO的转化率不变,故a错误;
b.该反应前后气体的物质的量不变,增大压强,平衡不移动,NO的转化率不变,故b错误;
c.反应移动存在热效应,升高温度,平衡一定移动,NO转化率一定变化,故c正确;
d.移去部分生成物F,平衡向正反应移动,NO的转化率增大,故d正确;故答案为:cd;
(2)①反应器中二氧化硫、碘发生氧化还原反应生成硫酸和HI,离子反应为SO2+I2+2H2O=SO42-+2I-+4H+,
故答案为:SO2+I2+2H2O=SO42-+2I-+4H+;
②HI分解反应为可逆反应,则使用膜反应器分离出H2的目的是及时分离出产物H2,有利于反应正向进行,
故答案为:HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
(3)根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;O2+4e-+4H+=2H2O.
点评 本题考查平衡常数及化学平衡的有关计算、平衡的移动以及原电池的工作原理等,难度中等,由于该反应的热效应不知,故T1和T2的关系无法比较,此为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯通入KMnO4溶液中 | B. | 乙烯通入溴水中 | ||
| C. | 甲烷和氯气混合光照 | D. | 苯与浓硫酸、浓硝酸混合加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:Y>X>Z>W | B. | 离子半径:X+>Y2+>Z->W2- | ||
| C. | 原子最外层电子数:Z>W>Y>X | D. | 原子半径:X>Y>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
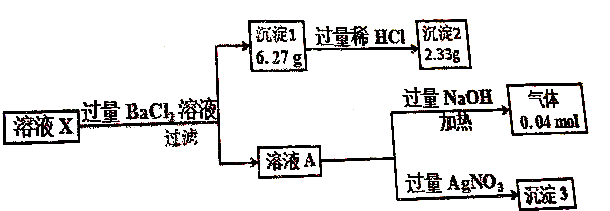
| A. | 溶液X中存在大量Mg2+ | |
| B. | 溶液X中一定存在K+ | |
| C. | 溶液X中c(CO32-)=0.02mol•L-1 | |
| D. | 溶液X中一定存在NH4+、Cl-、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 可以在空气中燃烧 | |
| B. | 与C12发生取代反应 | |
| C. | 可以与溴水中的溴反应而使溴水褪色 | |
| D. | 能使高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液中通入SO2气体 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| B. | 碳酸氢钙溶液中加入过量的氢氧化钠溶液 HCO3-+OH-═CO32-+H2O | |
| C. | 明矾溶液中加入过量的Ba(OH)2溶液2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 过量的NH4HSO4溶液与Ba(OH)2溶液反应2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 苯与氢气的反应: +3H2$→_{△}^{Ni}$ +3H2$→_{△}^{Ni}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④ | C. | ②④⑤⑥ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ 其热化学方程式为:N2(g)+3H2(g)$?_{500℃/30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则1mol稀H2SO4和足量KOH反应的反应热为△H=2×(-57.3)kJ/mol | |
| D. | 同温同压下H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件的△H不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com