
 请在标有序号的空白处填空:
请在标有序号的空白处填空:分析 I、(1)决定反应速率大小的主要因素是反应物本身的性质;
(2)改变反应速率的手段有:改变反应物的浓度、改变体系的压强、改变温度和使用催化剂等,据此分析;
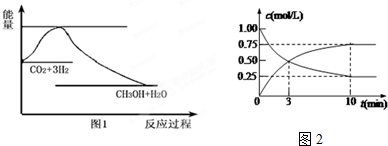
II、(1)反应物总能量大于生成物总能量,为放热反应,加入催化剂,活化能减小,反应反应热不变;
(2)根据反应2SO2(g)+O2(g)=2SO3(g)结合1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1计算反应热;
(3)V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成V2O5;
(4)依据化学反应速率之比等于系数之比计算得到.
解答 解:I、(1)决定反应速率大小的主要因素是反应物本身的性质,由于铝比铁活泼,故和等浓度的盐酸反应,反应速率铝更快,故答案为:<;
(2)①升高温度,反应速率加快,故答案为:加快反应速率;
②增大反应物的浓度,反应速率加快,故增大盐酸浓度,能加快反应速率,故答案为:加快反应速率;
③增大铁的质量,由于铁是固体,铁的浓度并不改变,故对反应速率无影响,故答案为:无影响;
④增加盐酸体积只是增大了盐酸的用量,盐酸的浓度不变,则对反应速率无影响,故答案为:无影响.
II、(1)因图中A、C分别表示反应物总能量、生成物总能量,E为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂,活化能减小,反应反应热不变;
故答案为:反应物能量;生成物能量;无;降低;因为催化剂改变了反应的历程,降低了正逆反应的活化能E;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJ•mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198KJ•mol-1,故答案为:-198KJ•mol-1;
(3)V2O5氧化SO2时,自己被还原为四价钒化合物,还生成三氧化硫;四价钒化合物再被氧气氧化生成V2O5,该催化循环机理的化学方程式为SO2+V2O5═SO3+2VO2、4VO2+O2═2V2O5,故答案为:SO2+V2O5═SO3+2VO2、4VO2+O2═2V2O5;
(4)反应的化学方程式为:2SO2(g)+O2(g)?2SO3(g),反应速率之比等于系数之比,v(SO2):v(O2):v(SO3)=2:1:2,反应速率υ(SO2)为0.05mol•L-1•min-1,依据比例计算得到v(O2)=0.025mol/L•min;v(SO3)=0.05mol•L-1•min-1,
故答案为:0.025mol•(L•min)-1;0.05mol•(L•min)-1.
点评 本题考查反应热与焓变,为高频考点,把握热化学反应方程式的书写、盖斯定律的应用为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | Ca2+、K+、Cl-、SO32- | B. | NH4+、Fe2+、I一、SO42- | ||
| C. | Na+、K+、ClO-、S2- | D. | Na+、S2O32-、AlO2-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
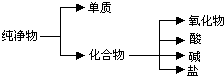 (1)纯净物根据其组成和性质可进行如图分类:
(1)纯净物根据其组成和性质可进行如图分类:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体粒子的直径在1~100 nm之间 | |
| B. | Fe(OH)3胶体具有丁达尔效应 | |
| C. | Fe(OH)3胶体是均一的分散系 | |
| D. | Fe(OH)3胶体的分散质能通过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com