
| A. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1560kJ•mol-1 | |
| B. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g)△H=-1560kJ•mol-1 | |
| C. | C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-52.0kJ•mol-1 | |
| D. | 2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l)△H=+3120 kJ•mol-1 |
分析 1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则1mol乙烷完全燃烧生成液体水放出的热量为52kJ×$\frac{1mol×30g/mol}{1g}$=1560kJ,则△H=-1560kJ•mol-1,注明物质的聚集状态书写热化学方程式,注意反应焓变与乙烷的化学计量数成正比关系.
解答 解:1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则1mol乙烷完全燃烧生成液体水放出的热量为52kJ×$\frac{1mol×30g/mol}{1g}$=1560kJ,则△H=-1560kJ•mol-1,则乙烷燃烧的热化学方程式为:C2H6(g)+$\frac{7}{2}$O2(g)═2CO2(g)+3H2O(l)△H=-1560kJ•mol-1,
故选:A.
点评 本题主要考查学生热化学方程式的书写,侧重考查学生的分析能力,注意焓变的正负和单位问题、物质的聚集状态,该题型是考试的热点.


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙醇在铜催化加热下可制得乙醚 | |
| B. | 淀粉在稀硫酸催化加热下可制得氨基酸 | |
| C. | 苯和乙烯在一定条件下反应可制得乙苯 | |
| D. | 乙苯与酸性高锰酸钾溶液反应生成苯乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
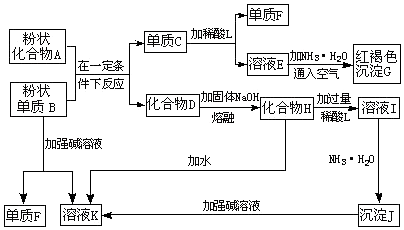
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
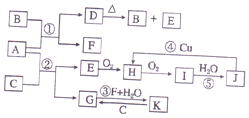 如图是由常见元素组成的一些单质及其化合物之间的转化关系图.常温常压下,B、E、F、H、I均为气体,F无色无味,且能使澄清石灰水变浑蚀;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色.A是一种常见的氮肥,F也能由人直接分解可得到.C、G、K的焰色反应呈黄色.(反应中部分生成物己略去)
如图是由常见元素组成的一些单质及其化合物之间的转化关系图.常温常压下,B、E、F、H、I均为气体,F无色无味,且能使澄清石灰水变浑蚀;B、E、I均有刺激性气味,E能使湿润的红色石蕊试纸变蓝,B、E在空气中相遇会产生白烟,I为红棕色.A是一种常见的氮肥,F也能由人直接分解可得到.C、G、K的焰色反应呈黄色.(反应中部分生成物己略去)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅熔点高,可用于制光导纤维 | |
| B. | 浓硫酸具有脱水性,可用于干燥气体 | |
| C. | 次氯酸钙具有强氧化性,可用于消毒杀菌 | |
| D. | 氯化铁易水解,可用于腐蚀铜制线路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下水电离的c(H+)为1×10-12mol/L的溶液中:Fe2+、Na+、SO42-、NO3- | |
| B. | 滴加石蕊后呈蓝色的溶液中:K+、AlO2-、Cl-、HCO3- | |
| C. | 含有大量HCO3-的澄清透明溶液中:K+、Al3+、SO42-、Na+ | |
| D. | 常温下c(OH-)/c(H+)=1014的溶液中:K+、Ba2+、Cl-、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com