
| A. | 足量乙酸与碳酸钠溶液反应:2 CH3COOH+CO32-→2CH3COO-+CO2↑+H2O | |
| B. | 醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O | |
| C. | 苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| D. | 乙醛溶液与足量的银氨溶液共热CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O |
分析 A.碳酸钠溶液与足量乙酸反应生成醋酸钠,二氧化碳和水;
B.醋酸溶液与新制氢氧化铜反应生成醋酸铜和水;
C.苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢钠;
D.乙醛溶液与足量的银氨溶液共热生成醋酸氨,银,氨气和水;
解答 解:A.碳酸钠溶液与足量乙酸反应生成醋酸钠,二氧化碳和水,故离子方程式为2 CH3COOH+CO32-→2CH3COO-+CO2↑+H2O,故A正确;
B.醋酸溶液与新制氢氧化铜反应生成醋酸铜和水,故离子方程式为2CH3COOH+Cu(OH)2→Cu2++2CH3COO-+2H2O,故B正确;
C.苯酚钠溶液中通入少量二氧化碳,由于苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢根离子,正确的离子方程式为:C6H6O-+CO2+H2O→C6H5OH+HCO3-,故C错误;
D.乙醛溶液与足量的银氨溶液共热生成醋酸氨,银,氨气和水,故离子方程式为CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O,故D正确;
故选C.
点评 本题考查了离子方程式的判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,C为易错点,注意苯酚的酸性大于碳酸氢根离子,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:推断题
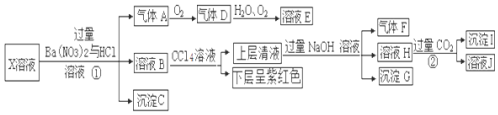
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:F2>Cl2 | B. | 碱性:Mg(OH)2>Al(OH)3 | ||
| C. | 金属单质置换出氢的能力:K>Na | D. | 酸性:H2SO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
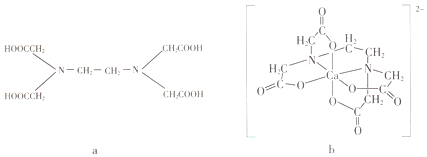 a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )
a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物.b为EDTA与Ca2+形成的螯合物.下列叙述正确的是( )| A. | b含有分子内氢键 | B. | b中Ca2+的配位数为4 | ||
| C. | b含有共价键、离子键和配位键 | D. | a和b中的N原子均为sp3杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中必含离子键 | D. | 共价化合物中不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 序号 | 烧杯中的液体 | 5分钟后现象 |
| ① | 2mL 1mol•L-1KI溶液+5滴淀粉 | 无明显变化 |
| ② | 2mL1mol•L-1KI 溶液+5 滴淀粉+2mL0.2mol•L-1HC1 | 溶液变蓝 |
| ③ | 2mLl mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1KC1 | 无明显变化 |
| ④ | 2mL1mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1CH3COOH | 溶液变蓝,颜色 较②浅 |
| 序号 | 烧杯中的液体 | 5小时后现象 |
| ⑤ | 2mL混有KOH的pH=8.5的lmol•L-1KI溶液+5滴淀粉 | 溶液略变蓝 |
| ⑥ | 2mL混有KOH的pH=10的lmol•L-1KI溶液+5滴淀粉 | 无明显变化 |
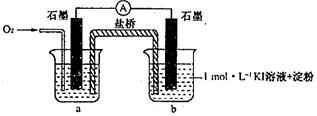
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在普通钢中加入镍、铬等多种元素可炼成不锈钢 | |
| B. | 硬铝、青铜、金箔都属于合金,合金的性能一般优于纯金属 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着致密的氧化膜,对内部金属起保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
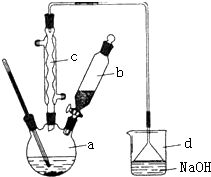 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 ,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色植物的光合作用是把热能转化为化学能的过程 | |
| B. | 生物质能是与化学反应无关的一种能源 | |
| C. | 物质燃烧一定是放热反应 | |
| D. | 化学能只能以热能的形式释放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com