
| A. | Ag+、Cu2+与NH3形成配合物时的配位数 | |
| B. | NaCl的晶格能与MgO的晶格能 | |
| C. | H-F键的极性与H-O键的极性 | |
| D. | BF3的键角CS2的键角 |
分析 A.Ag+与NH3形成[Ag(NH3)2]+,Cu2+与NH3形成[Cu(NH3)4]2+;
B.晶格能与离子半径和离子的电荷有关;
C.两种元素非金属性差距越大,其共价键的极性越大;
D.BF3分子为正三角形,CS2分子为直线型.
解答 解:A.Ag+与NH3形成[Ag(NH3)2]+,Cu2+与NH3形成[Cu(NH3)4]2+,配位数前者小于后者,故A错误;
B.离子晶体中离子半径越小,离子的电荷越多,晶体的晶格能越大,所以NaCl的晶格能小于MgO的晶格能,故B错误;
C.两种元素非金属性差距越大极性越大,F-H之间的非金属性之差大于O-H之间的非金属性之差,所以F-H键的极性强于O-H键的极性,故C正确;
D.BF3分子为正三角形,键角为120°,CS2分子为直线型,键角为180°,即BF3的键角小于CS2的键角,故D错误.
故选C.
点评 本题考查物质结构、性质,涉及化学键、晶格能、共价键的极性、键角等知识点,这些都是高频考点,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力,注意相关知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 海水提溴时用到热空气将Br2吹出 | B. | 工业制HCl时氯气在氢气中燃烧 | ||
| C. | 硫酸工业中使用到热交换器 | D. | 石油通过分馏得到裂化汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
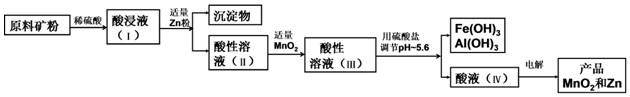
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
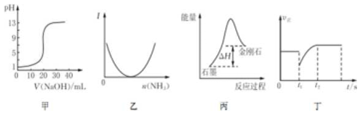
| A. | 图甲表示0.10mol•L-1NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 图乙表示向乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 根据图丙所示可知:石墨转化为金刚石吸收热量,石墨比金刚石稳定 | |
| D. | 图丁表示反应2SO2+O2?2SO3,t1时刻只减小了 SO3的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②③④ | C. | ②③④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
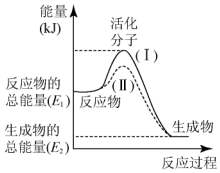 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
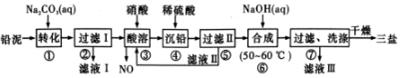
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为补充土壤中的钾元素,可在田间焚烧秸秆 | |
| B. | 煤经过气化、液化等物理变化可转变为清洁燃料 | |
| C. | 聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染 | |
| D. | 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原混合气体中H2S的体积可能是75mL | |
| B. | 原混合气体中O2的体积可能是50mL | |
| C. | 剩余25 mL气体可能全部是SO2 | |
| D. | 剩余25 mL气体可能是SO2与O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com