(2013?杭州一模)某种甲酸酯水解反应方程式为:
HCOOR(l)+H
2O(l)?HCOOH(l)+ROH (l)△H>0
某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始浓度如下表:
| 组分 |
HCOOR |
H2O |
HCOOH } |
ROH |
| 物质的量浓度/mol?L-1’ |
1.00 |
1.99 |
0.01 |
0.52 |
甲酸酯转化率在温度T
1下随反应时间(t)的变化如图:
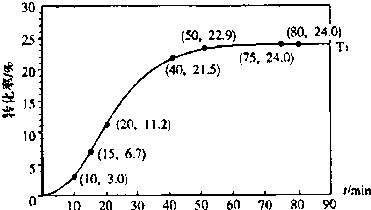
根据上述条件,计算不同时间范围内甲酸醋的平均反应速率,结果见下表:
| 反应时间/min |
0~5 |
10~15 |
20~25 |
30~35 |
40~45 |
50~55 |
75~80 |
| 平均速率/10-3mol?L-1?min-1 |
1.9 |
7.4 |
7.8 |
4.4 |
1.6 |
0.8 |
0.0 |
(1)该反应的平衡常数K 的表达式
| c(ROH)c(HCOOH) |
| c(HCOOR)c(H2O) |
| c(ROH)c(HCOOH) |
| c(HCOOR)c(H2O) |
(不要求计算);T
1温度下平衡体系中.c(ROH )为
0.76
0.76
mol?L一1
(2)15~20min范围内用甲酸酯表示的平均反应速率为
0.009
0.009
mol?L
-1?min
-1,(不要求写出计算过程).
(3)根据题给数据分析,从影响反应速率的角度来看,生成物甲酸在该反应中还起到了
催化剂
催化剂
的作用.




 导学全程练创优训练系列答案
导学全程练创优训练系列答案