
 ,故答案为:第二周期ⅥA族;
,故答案为:第二周期ⅥA族; ;
;

科目:高中化学 来源: 题型:
| A、福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集溜出物 |
| B、乙醇(乙醛):加新制Cu(OH)2溶液,加热至沸腾,过滤取溶液 |
| C、苯(苯酚):加NaOH溶液,充分振荡,分液,弃水层 |
| D、乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
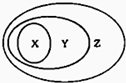 如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中正确的是 ( )
如图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中正确的是 ( )| X | Y | Z | |
| A | 置换反应 | 氧化还原反应 | 离子反应 |
| B | 铜 | 单质 | 非电解质 |
| C | 石灰水 | 电解质 | 分散系 |
| D | 液氨 | 化合物 | 纯净物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
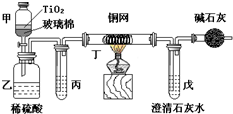 电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:
电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代.处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成OCN-,再在酸性条件下继续被NaClO氧化成N2和CO2.环保工作人员在密闭系统中用如图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率.将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200mL(其中CN-的浓度为0.05mol?L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 以下各种有机化合物之间有如图的转化关系:
以下各种有机化合物之间有如图的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用加热法可除去Na2CO3中的NaHCO3 |
| B、Na、Mg、Fe等金属在一定条件下与水反应都生成H2和对应的碱 |
| C、可用石灰水区分Na2CO3与NaHCO3溶液 |
| D、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com