
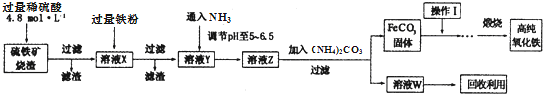


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
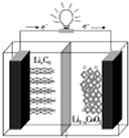 某种聚合物锂离子电池放电时的反应为Li1-xCoO2+LixC6═6C+LiCoO2,其电池如图所示.下列说法不正确的是( )
某种聚合物锂离子电池放电时的反应为Li1-xCoO2+LixC6═6C+LiCoO2,其电池如图所示.下列说法不正确的是( )| A、放电时,LixC6发生氧化反应 |
| B、充电时,Li+通过阳离子交换膜从左向右移动 |
| C、充电时将电池的负极与外接电源的负极相连 |
| D、放电时,电池的正极反应为Li1-xCoO2+xLi++xe-═LiCoO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
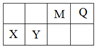 4种短周期元素相对位置如右表.M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素.回答下列问题:
4种短周期元素相对位置如右表.M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴极附近溶液呈红色 |
| B、阴极逸出气体 |
| C、阳极附近溶液呈蓝色 |
| D、溶液的pH变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
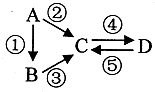 A、B、C、D均为中学化学常见的、含同种元素的纯净物,A为单质,它们间有如图反应关系.根据要求回答问题:
A、B、C、D均为中学化学常见的、含同种元素的纯净物,A为单质,它们间有如图反应关系.根据要求回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
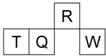 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中Q单质可制成半导体材料.下列判断正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中Q单质可制成半导体材料.下列判断正确的是( )| A、W形成的离子半径大于T形成的离子半径 |
| B、W的单质在过量氧气中燃烧生成WO3 |
| C、最高价氧化物的水化物的酸性:R<Q |
| D、T是地壳中含量最多的金属元素,其单质的化学性质较活泼 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com