
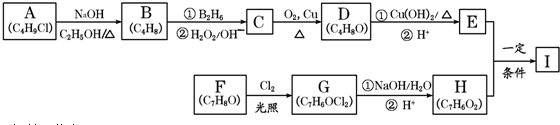
 ,该反应类型为取代反应.
,该反应类型为取代反应. .
. .
. 分析 A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,则A为(CH3)3CCl,在氢氧化钠醇溶液、加热条件下发生消去反应,生成B为CH2=C(CH3)2,B发生信息2中的反应生成C为(CH3)2CHCH2OH,C发生催化氧化生成D为(CH3)2CHCHO,D再与氢氧化铜反应,酸化得到E为(CH3)2CHCOOH,
F的分子式为C7H8O,苯环上的一氯代物只有两种,应含有2个不同的侧链,且处于对位,则F为 ,与氯气在光照条件下发生取代反应,生成G为
,与氯气在光照条件下发生取代反应,生成G为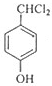 ,G在氢氧化钠水溶液发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为
,G在氢氧化钠水溶液发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为 ,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为
,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为 ,据此分析解答.
,据此分析解答.
解答 解:A的分子式为C4H9Cl,核磁共振氢谱表明其只有一种化学环境的氢,则A为(CH3)3CCl,在氢氧化钠醇溶液、加热条件下发生消去反应,生成B为CH2=C(CH3)2,B发生信息2中的反应生成C为(CH3)2CHCH2OH,C发生催化氧化生成D为(CH3)2CHCHO,D再与氢氧化铜反应,酸化得到E为(CH3)2CHCOOH,
F的分子式为C7H8O,苯环上的一氯代物只有两种,应含有2个不同的侧链,且处于对位,则F为 ,与氯气在光照条件下发生取代反应,生成G为
,与氯气在光照条件下发生取代反应,生成G为 ,G在氢氧化钠水溶液发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为
,G在氢氧化钠水溶液发生水解反应,酸化得到H,由于同一个碳原子上连有两个羟基不稳定,易脱水形成羰基,故H为 ,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为
,H与E发生酯化反应生成I,其分子中含有醛基和酯基,故I为 ,
,
(1)由上述分析可知,D为(CH3)2CHCHO,
故答案为:(CH3)2CHCHO;
(2)E为(CH3)2CHCOOH,其分子式为C4H8O2,
故答案为:C4H8O2;
(3)F生成G的化学方程式为 ,该反应类型为取代反应,
,该反应类型为取代反应,
故答案为: ;取代反应;
;取代反应;
(4)由上述分析可知,I的结构简式为 ,
,
故答案为: ;
;
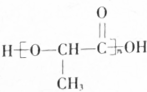
(5)I( )的同系物J比I相对分子质量小14,J比I少一个-CH2-原子团,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,则J的同分异构体含有-CHO、-COOH,
)的同系物J比I相对分子质量小14,J比I少一个-CH2-原子团,J的同分异构体中能同时满足如下条件:①苯环上只有两个取代基,②既能发生银镜反应,又能与饱和NaHCO3溶液反应放出CO2,则J的同分异构体含有-CHO、-COOH,
侧链为-CHO、-CH2CH2COOH,有邻、间、对三种位置,
侧链为-CHO、-CH(CH3)COOH,有邻、间、对三种位置,
侧链为-CH2CHO、-CH2COOH,有邻、间、对三种位置,
侧链为-CH2CH2CHO、-COOH,有邻、间、对三种位置,
侧链为-CH(CH3)CHO、-COOH,有邻、间、对三种位置,
侧链为-CH3、-CH(CHO)COOH,有邻、间、对三种位置,
故符合条件的同分异构体有6×3=18种,
J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,而J的同分异构体发生银镜反应并酸化后的产物苯环侧链至少有2种H原子,故产物中苯环上只有1种H原子,产物有2个-COOH,应还含有2个-CH2-,2个侧链相同且处于对位,产物中侧链为-CH2COOH,故符合条件的同分异构体结构简式为: ,
,
故答案为:18; .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识迁移能力,根据某些物质分子式、反应条件及题给信息进行推断,(6)中同分异构体的书写是易错点、难点,题目难度中等.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2+2NaOH═Cu(OH)2↓+2NaCl | B. | CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$CO2+Cu | ||
| C. | Mg+2HCl═MgCl2+H2↑ | D. | Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3中的氯元素被氧化 | |
| B. | Cl2既是氧化剂,又是还原剂 | |
| C. | 还原剂是HCl | |
| D. | 每生成1mol Cl2转移电子的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
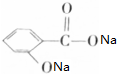
 Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )
Na、NaOH、NaHCO3分别与等物质的量的该物质反应时,则消耗Na、NaOH、NaHCO3的物质的量之比为( )| A. | 3:3:3 | B. | 3:2:2 | C. | 3:2:1 | D. | 1:1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应 | |
| B. | NaHCO3俗称小苏打,Na2CO3俗称苏打或纯碱 | |
| C. | Na2CO3很稳定,而NaHCO3受热时容易分解 | |
| D. | 将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
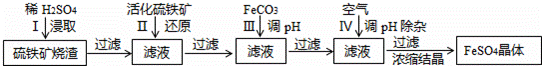
 .合成N、F的路线如下:
.合成N、F的路线如下: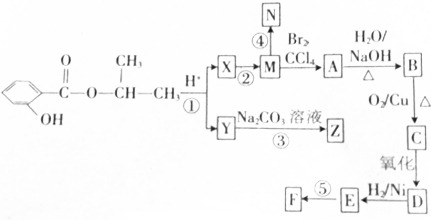
 ,写出与X具有相同官能团的一种同分异构体的名称:1-丙醇.
,写出与X具有相同官能团的一种同分异构体的名称:1-丙醇. →
→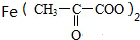 +H2↑.
+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com