
在5L的密闭容器中进行下述反应 ,30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
,30S内,NO增加了0.3mol,则在30S内,该反应的平均反应速率正确的是
A.V(O2 )=0.01mol·L-1·s-1 B. V(NO )=0.08mol·L-1·s-1
C. V(H2O)=0.01mol·L-1·s-1 D. V(NH3)=0.002mol·L-1·s-1
【考点】本题考查化学反应速率的计算,比较基础,反应速率计算通常有定义法、化学计量数法,根据情况选择合适的方法。
【解析】在5L的密闭容器中进行30s后,NO的物质的量增加了0.3mol,则v(NO)=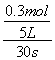 =0.002mol/(L•min)。
=0.002mol/(L•min)。
A、速率之比等于化学计量数之比,所以v(O2)=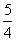 v(NO)=
v(NO)=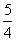 ×0.002mol/(L•min)=0.0025mol/(L•min),故A错误;
×0.002mol/(L•min)=0.0025mol/(L•min),故A错误;
B、v(NO)=0.002mol/(L•min),故B错误;
C、速率之比等于化学计量数之比,所以v(H2O)=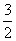 v(NO)=
v(NO)=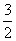 ×0.002mol/(L•min)=0.003mol/(L•min),故C错误;
×0.002mol/(L•min)=0.003mol/(L•min),故C错误;
D、速率之比等于化学计量数之比,所以v(NH3)=v(NO)=0.002mol/(L•min),故D正确。
【答案】D


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
反应A+3B=4C+2D,在不同条件下反应,其平均反应速率v(X)(表示反应物的消耗速率或生成物的生成速率)如下,其中反应速率最快的是
A.v(A)=0.4mol/(L·s) B.v(B)=0.8mol/(L·s)
C.v(C)=1.2mol/(L·s) D.v(D)=0.7mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
世博会中国馆、主题馆等建筑所使用的光伏电池,总功率达4兆瓦,是历届世博会之最。下列有关叙述正确的是( )
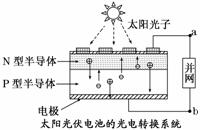
A.光伏电池是将太阳能转变为电能
B.光伏电池是将化学能转变为电能
C.电流从a流向b
D.图中N型半导体为正极,P型半导体为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) Ag2O2是银锌碱性电池的正极活性物质,其电解质溶液为 KOH 溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反 应方程式:__________________________________________________。
应方程式:__________________________________________________。
 (2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS===Na2Sx,正极的电极反应式为____________。M(由Na2O和Al2O3制得)的两个作用是______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。
(2)如图为钠高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+xS===Na2Sx,正极的电极反应式为____________。M(由Na2O和Al2O3制得)的两个作用是______________________。与铅蓄电池相比,当消耗相同质量的负极活性物质时,钠硫电池的理论放电量是铅蓄电池的________倍。
(3)以甲醇为燃料的电池中,电解质溶液为酸性,负极的反应式为________________________________,正极的反应式为________________。理想状态下,该燃料电池消耗1 mol 甲醇所能产生的最大电能为702.1 kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比,甲醇的燃烧热为ΔH=-726.5 kJ/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素Y的原子获得3个电子或元素X的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确化学式是
A.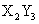 B.
B. C.
C.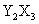 D.
D.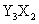
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:(1)Na3N的电子式是__________;该化合物是由__________键形成的__________(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是
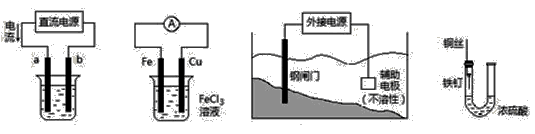
① ② ③ ④
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+= Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,10 mL0.1mol·L-1的氨水加水稀释后,下列说法正确的是
A.溶液的pH增大
B.溶液中NH4+和OH—离子的数目减少
C.NH3·H2O的电离程度增大,c(H+)也增大
D.加入适量盐酸使c(NH+4)=c(Cl—),混合液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸钠和碳酸钠的混合物4.96 g中加入足量的4.80%的盐酸(密度为1.02 g/mL),充分反应后,在标准状况下收集到0.448 L二氧化碳。试求:
(1)混合物中碳酸钠的物质的量。
(2)混合物中硫酸钠的质量分数(保留两位小数)。
(3)盐酸的物质的量浓度(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com