
| 点燃 |
| V |
| Vm |
| 2.24L |
| 22.4L/mol |
| 点燃 |
| n |
| c |
| 0.2mol |
| 2mol/L |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
| A、含有 NA个氦原子的氦气(氦气是单原子分子)在标准状况下的体积约为11.2L |
| B、在标准状况下,11.2L H2O含有的分子数为0.5NA |
| C、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| D、.25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离产生的c(OH-)=10-12mol?L-1 | ||
| B、向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) | ||
| C、等体积pH=12的氨水和pH=12的NaOH溶液可中和等物质的量的HCl | ||
D、用水稀释时,溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | T/℃ | n(CO)/n(H2) | p/MPa |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、D的质量不再改变 |
| B、各组分的浓度不再改变 |
| C、反应速率υA:υB:υC:υD=m:n:p:q |
| D、单位时间内m mol A断键发生反应,同时p mol C也断键发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
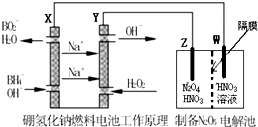 N2O5是一种新型绿色硝化剂,一种制备方法是用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图:(隔膜不允许水分子通过,H+可以通过)下列说法正确的是( )
N2O5是一种新型绿色硝化剂,一种制备方法是用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图:(隔膜不允许水分子通过,H+可以通过)下列说法正确的是( )| A、Y是负极,电极反应式:H2O2+2e-=2OH- |
| B、Z是阳极,电极反应式为:N2O4+2HNO3-2e-=2N2O5+2H+ |
| C、电流从X流出经导线流入W极 |
| D、制备10.8gN2O5至少需要消耗硼氢化钠0.87g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
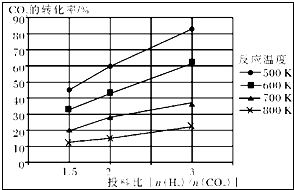
| 1 |
| 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| B | 2P轨道上有二个孤电子 |
| C | 与B同主族 |
| D | 前四周期中金属性最强的元素 |
| E | 前四周期中原子核外孤电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28 g C2H4中含有2 NA个碳原子 |
| B、常温常压下,22.4L氦气含有的原子数为2NA |
| C、1mol S在足量O2中燃烧,转移的电子数为6 NA |
| D、0.1 mol?L-1的碳酸氢钠溶液中含钠离子数为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com