
25℃时,在等体积的下列溶液中,发生电离的水的物质的量之比是
①0.5 mol·L-1的H2SO4溶液,②0.05 mol·L-1的Ba(OH)2溶液,③1 mol·L-1的NaCl溶液,④纯水
A.107∶107∶1∶1 B.1∶10∶107∶107
C.107∶106∶2∶2 D.107∶106∶2×107∶2
科目:高中化学 来源:2016-2017学年广东省高一上期中化学卷(解析版) 题型:选择题
关于物质的类别,下列说法正确的是
A.食盐水、糖水和冰水都是饮料,属于混合物
B.O2不能导电,故O2是非电解质
C.烧碱属于碱,纯碱属于盐
D.NaHSO4能电离出 氢离子,故NaHSO4属于酸
氢离子,故NaHSO4属于酸
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上期中化学试卷(解析版) 题型:选择题
下列变化属于吸热反应的是 ①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰
A、①④⑤ B、①②④ C、②③ D、②④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上阶段考二文化学卷(解析版) 题型:选择题
下列有关环境保护的说法中错误的是( )
A.含氮、磷化合物的生活污水大量排放可使水体富营养化
B.各国工业大量排放二氧化硫是全球气候变暖的主要原因
C.劣质装修材料中的甲醛、苯、氡气等对人体有害
D.废旧电池中的汞、镉、铅等重金属盐对土壤和水源会造成污染
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:填空题
25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 mol·L-1 | K1=4.4×10-7 mol·L-1 K2=5.6×10-11 mol·L-1- | 3.0×10-8mol·L-1 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为________________。
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+)
B.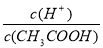
C.c(H+)·c(OH-)
D.
E.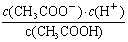
若该溶液升高温度,上述5种表达式的数据增大的是___________。
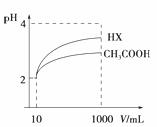
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。稀释后,HX溶液中由水电离出来的c(H+) __________(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是______________________________。
(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显__________(填“酸”、“碱”或“中”)性。将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)  B(g) + C(g);ΔH = -48.25 kJ.mol-1,反应过程中B、A的浓度比与时间t下图所示关系,若测得第15min时c(B)=1.6 mol.L-1,则下列结论正确的是
B(g) + C(g);ΔH = -48.25 kJ.mol-1,反应过程中B、A的浓度比与时间t下图所示关系,若测得第15min时c(B)=1.6 mol.L-1,则下列结论正确的是

A.该温度下此反应平衡常数为3.2
B.A的初始物质的量为4 mol
C.反应达到平衡时,A的转化率为80%
D.反应达到平衡时,放出的热量是193kJ
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上期中化学卷(解析版) 题型:选择题
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol 下列结论正确的是
A.碳的燃烧热等于110.5kJ/mol
B.2molC(s)在2molO2(g)燃烧, 放出221kJ热量
C.1L 0.1mol/L硫酸溶液与1L pH=11的NaOH溶液反应,放出5.73kJ热量
D.pH=3的醋酸与pH=11的NaOH溶液反应生成1mol水,放出57.3kJ热量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上期中化学卷(解析版) 题型:选择题
常温下,在溶液中可发生以下反应:
①2Fe2++Br2═2Fe3++2Br-,②2Br-+Cl2=Br2+2Cl-,
③2Fe3++2I-═2Fe2++I2。由此判断下列说法正确的是
A.铁元素在反应①和③中均被氧化
B.反应②中当有1 mol Cl2被还原时,有2 mol Br﹣被氧化
C.氧化性强弱顺序:Cl2>Br2>I2>Fe3+
D.还原性强弱顺序:I﹣>Br﹣>Fe2+>Cl﹣
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上期中化学卷(解析版) 题型:选择题
已知一种c(H+)=1×10-3 mol/L的酸溶液和一种c(OH-)=1×10-3 mol/L 的碱溶液等体积混合后,溶液呈酸性,其原因可能是
A.浓的强酸和稀的强碱溶液 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com