
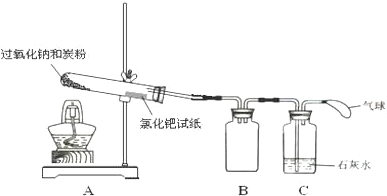
���� ��1��ʹװ�������γ�ѹǿ�����������װ�������ԣ�
��2��BΪ��ȫƿ��
��3������ԭ�Ӹ����غ��ж�X���ٸ��ݻ��ϼ��жϣ�
��4��n��Pd��=$\frac{53g}{106g/mol}$=0.5mol��ת�Ƶ��ӵ����ʵ���Ϊ1mol����ӦΪΪPdCl2��CO��H2O��������ӦΪCO2��HCl��
��5���ٷ�Ӧ����Na2CO3��Na2O��Na2O��ˮ��Ӧ����NaOH��
�ڷ�Ӧ����Һ�ʼ��ԣ���ϵ���غ��жϣ�
�۷�Ӧ��Һ����ΪNaCl�����������غ���㣮
��� �⣺��1������װ�������Է������ڹ��ƿC�м�ˮ��û���ܿڣ��þƾ�����A���Թܣ���C�е��ܿ�ð���ݣ��ƿ��ƾ�����ȴ���γ�ˮ����˵�����������ã�
�ʴ�Ϊ���ڹ��ƿC�м�ˮ��û���ܿڣ��þƾ�����A���Թܣ���C�е��ܿ�ð���ݣ��ƿ��ƾ�����ȴ���γ�ˮ����˵�����������ã�
��3��BΪ��ȫƿ���ɷ�ֹ�������ʴ�Ϊ����ֹ������
��3��2Na2O2+C$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+X����ԭ�Ӹ����غ㣬��֪X�к���2����ԭ��1����ԭ�ӣ�����XΪNa2O���ʴ�Ϊ��Na2O��
��4��n��Pd��=$\frac{53g}{106g/mol}$=0.5mol��ת�Ƶ��ӵ����ʵ���Ϊ1mol����ӦΪΪPdCl2��CO��H2O��������ӦΪCO2��HCl����Ӧ�ķ���ʽΪPdCl2+CO+H2O=Pd+CO2+2HCl��
�ʴ�Ϊ��PdCl2+CO+H2O=Pd+CO2+2HCl��
��5���ٷ�Ӧ����Na2CO3��Na2O��Na2O��ˮ��Ӧ����NaOH���ʴ�Ϊ��NaOH��Na2CO3��
������CO32-ˮ�⣬��c��CO32-����c��OH-������a����b��ȷ�����ݵ��Ӧ��Һ�л�����NaOH����c�����ɵ���غ��֪d��ȷ���ʴ�Ϊ��b d��
��n��Na2O2��=$\frac{3.9g}{78g/mol}$=0.05mol����Ӧ����Һ����ΪNaCl��������NaCl0.1mol��
����c��HCl��=c��NaCl��=$\frac{0.1mol}{0.1L}$=1mol/L��
�ʴ�Ϊ��1 mol/L��
���� ���⿼��ʵ��̽�����⣬�漰�������Ƶ����ʡ�����Ũ�ȱȽϵ����⣬�ѶȽϴ�ע����ݷ�Ӧ�������жϷ�Ӧԭ��������ʵ���������������Ϊ�߿��������ͣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
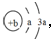 ��Y��ZΪͬ���ڽ���Ԫ�أ�����YΪ������Ԫ����ԭ�Ӱ뾶����Ԫ�أ�ZΪ�ؿ��к�����ߵĽ���Ԫ�أ�W������������Ӧˮ�������������̬�⻯�ﷴӦ������G����G��Һ�����ԣ��ش��������⣺
��Y��ZΪͬ���ڽ���Ԫ�أ�����YΪ������Ԫ����ԭ�Ӱ뾶����Ԫ�أ�ZΪ�ؿ��к�����ߵĽ���Ԫ�أ�W������������Ӧˮ�������������̬�⻯�ﷴӦ������G����G��Һ�����ԣ��ش��������⣺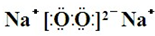 �������еĻ�ѧ������Ϊ���Ӽ����ۼ���
�������еĻ�ѧ������Ϊ���Ӽ����ۼ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �к��ȵIJⶨʵ��ʱ���۾�Ҫע���¶ȼƵĿ̶ȱ仯 | |
| B�� | ��ȡʱ��������������農�ã���Һ��ֲ����Ժ���ܷ�Һ | |
| C�� | �к͵ζ�ʵ��ʱ��Ϊ��ʹ�ζ��յ������������ԣ����Եμӽ϶��ָʾ�� | |
| D�� | ����ʱ���¶ȼƵĶ����մﵽij���ʵķе㣬���������ռ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͬ���ʵ���Ũ�ȵ�������Һ����NH4Al��SO4��2����NH4Cl����CH3COONH4����NH3•H2O�� c��NH4+���ɴ�С��˳���ǣ��٣��ڣ��ۣ��� | |
| B�� | ij��Һ����ˮ�������c��H+��=1��10-amol/L����a��7ʱ�������Һ��pHһ��Ϊ14-a | |
| C�� | ���ʵ���Ũ����ȵ� H2S �� NaHS �����Һ�У�c��Na+��=2c��S2-��+2c��HS-��+2c��H2S�� | |
| D�� | �����£���0.1mol/L NaHY��Һ��pH=4������Һ������Ũ�ȹ�ϵΪ��c��Na+����c��HY-����c��Y2-����c��H+����c ��H2Y�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2CO3��Na2SiO3 | B�� | Na2CO3��SiO2 | C�� | Na2SiO3 | D�� | SiO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ij��Ԫ�������ʽ��NaHA��Һ�У�c��H+��+c��Na+��=c��OH-��+c��HA-��+c��A2-�� | |
| B�� | ���ʵ���Ũ����ȵĢ�NH4HCO3��Һ����NH4Cl��Һ����NH4HSO4��Һ�У�c��NH4+���Ĵ�С��ϵ���٣��ڣ��� | |
| C�� | 0.1 mol•L-1 CH3COONa ��Һ��0.05 mol•L-1����������Ϻ��������Һ�У�c��CH3COO-����c��Cl-����c��CH3COOH����c��H+�� | |
| D�� | 0.1mol•L-1��NH4��2Fe��SO4��2��Һ�У�c��NH4+��+c��NH3•H2O��+c��Fe2+��=0.3 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ռ�����ʯ�Ҿ����ڼ� | |
| B�� | ϡ������FeCl3��Һ��ţ�̾����ڽ��� | |
| C�� | HCl��BaSO4��NH3•H2O�����ڵ���� | |
| D�� | MgO��CuO��Na2O2�����ڼ��������� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com