
分析 依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,ρ=$\frac{M}{Vm}$结合甲烷、氧气、二氧化碳的分子构成解答.
解答 解:依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$可知,相同质量气体,分子数与摩尔质量成反比,相同质量的O2、CH4、CO2三种气体中甲烷摩尔质量最小所以含分子数最多;
取三种气体1g,则氧气的物质的量为:$\frac{1}{32}$mol;甲烷分子的物质的量为:$\frac{1}{16}$mol;二氧化碳分子的物质量为:$\frac{1}{44}$mol,含有原子物质量依次为:$\frac{1}{32}$×2=$\frac{1}{16}$mol;$\frac{1}{16}$×5=$\frac{5}{16}$mol;$\frac{1}{44}$×3=$\frac{3}{44}$mol;所以含有原子数最多的为:CH4;
依据V=nVm可知,相同条件下,气体的体积与物质的量成正比,而相同质量的O2、CH4、CO2三种气体,二氧化碳物质的量最小,所以相同条件下二氧化碳体积最小;
依据ρ=$\frac{M}{Vm}$可知,相同条件下,密度最大的是CO2;
故答案为:CH4; CH4; CO2;CO2.
点评 本题考查物质的量的计算,侧重于学生计算能力的考查,注意把握相关计算公式的运用,难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 项目 | 结论 |
| A | 三种有机化合物:乙烷、氯乙烯、苯 | 分子内所有原子均在同一平面上 |
| B | C4H8Cl2的同分异构体数目(不考虑立体异构) | 共有10种 |
| C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
| D | 由乙酸和乙醇制乙酸乙酯,油脂水解 | 均属于取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
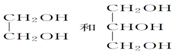
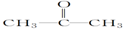
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
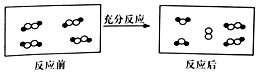 一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )
一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )| A. | 属于化合反应 | B. | 属于置换反应 | ||
| C. | 属于氧化还原反应 | D. | 属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol NaH参加反应失去1mol电子 | B. | 每生成1mol H2转移2mol电子 | ||
| C. | NaH既是氧化剂,又是还原剂 | D. | NaOH是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铅蓄电池在放电过程中,负极质量增加,正极质量也增加 | |
| B. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 相同条件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+,Cl-,MnO4-,SO42- | B. | Na+,SiO32-,NO3-,CO32- | ||
| C. | Na+,NO3-,SO42-,HCO3- | D. | Na+,SO42-,S2-,ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| C. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| D. | 防止酸雨发生的重要措施之一是使用清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com