
| A. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减少 | |
| B. | 一定温度下,向一定量纯水中通入少量HCl气体后,水的电离平衡正向移动 | |
| C. | 中和等体积等物质的量浓度的氨水和NaOH溶液时,消耗等浓度的稀硫酸的体积氨水比NaOH溶液多 | |
| D. | 室温下,pH=5的硫酸铵和pH=9醋酸钠两溶液中,由水电离出的氢离子浓度相等 |
分析 A.冰醋酸加水过程中,促进冰醋酸电离,氢离子浓度先增大后减小;
B.HCl能够抑制水的电离;
C.一水合氨和氢氧化钠都是一元碱,中和等体积等物质的量浓度的氨水和NaOH溶液时,消耗相同量的酸;
D.硫酸铵溶液和醋酸钠溶液中的氢离子和氢氧根离子都是有水电离出来的.
解答 解:A.冰醋酸是分子晶体,向冰醋酸中加水,促进冰醋酸电离,氢离子浓度逐渐增大,增大到一定程度时,再向溶液中加水稀释,溶液中离子浓度反而减小,故A错误;
B.HCl能够抑制水的电离,所以向一定量纯水中通入少量HCl气体后,水的电离平衡逆向移动,故B错误;
C.一水合氨和氢氧化钠都是一元碱,中和等体积等物质的量浓度的氨水和NaOH溶液时,消耗等浓度的稀硫酸的体积相同,故C错误;
D.水电离出来的氢离子浓度与氢氧根离子浓度相同,pH=5的硫酸铵中水电离出来的氢离子浓度为10-5mol/L,pH=9醋酸钠溶液中水电离出来的氢氧根离子浓度为10-5mol/L,所以pH=5的硫酸铵和pH=9醋酸钠两溶液中,由水电离出的氢离子浓度相等,故D正确;
故选D.
点评 本题考查了弱电解质的电离、电离平衡移动的影响因素、中和和中性的关系、盐类水解,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 区别苯和乙苯:加酸性高锰酸钾溶液,振荡,观察现象 | |
| B. | 检验无水乙醇中是否含有少量水:加硫酸铜晶体观察现象 | |
| C. | 乙醇的消去反应、油脂的皂化反应、淀粉的水解反应均可用浓硫酸作催化剂 | |
| D. | 检验氯代烃中的氯元素时,可先加氢氧化钠溶液加热,再加入硝酸溶液,最后加入硝酸银溶液来进行检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液、足量的Na2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加.据此回答下列问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaOH溶液、足量的CuSO4溶液、足量的Na2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加.据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾的原子质量就是钾的相对原子质量 | |
| B. | 一个硫原子的实际质量约等于$\frac{32}{(6.02×1{0}^{23})}$g | |
| C. | 水的相对分子质量为18g | |
| D. | 17g OH-中所含电子数为9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时电解质溶液中的OH-向正极移动 | |
| B. | 充电过程是化学能转化为电能的过程 | |
| C. | 放电时电子从正极经过外线路流向负极 | |
| D. | 充电时Ni(OH)2在阴极失电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
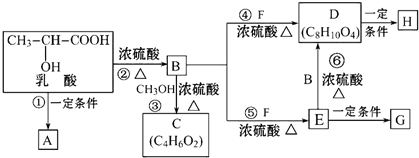
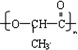 ;
;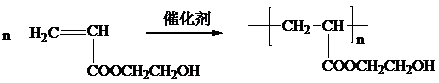 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由乙烯与氧气在Ag作催化剂下反应制取环氧乙烷原子利用率可达100% | |
| B. | 高聚物的相对分子质量一定为单体相对分子质量的整数倍 | |
| C. |  分子中只存在羧基、羟基两种官能团 分子中只存在羧基、羟基两种官能团 | |
| D. |  分子中至少有14个原子共平面 分子中至少有14个原子共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<△H2 | B. | △H1=△H2 | C. | △H1>△H2 | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com