
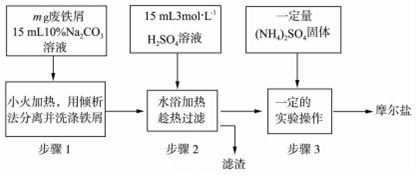
分析 用碳酸钠溶液可以处理铁屑表面的油污等杂质,得到的铁和硫酸反应可以生成硫酸亚铁溶液,铁过量,过量过量的铁,得硫酸亚铁溶液,加入硫酸铵混合固体充分搅拌溶解,采取蒸发浓缩、冷却结晶过滤、洗涤、干燥得到较为摩尔盐晶体,
(1)Na2CO3溶液中CO32-水解CO32-+H2O?HCO3-+OH-,使平衡右移,增强溶液碱性;由固体药品配制溶液需要的仪器有药匙、量筒、烧杯、玻璃棒和天平;
(2)铁防止铁离子被氧化;
(3)硫酸亚铁溶液,加入硫酸铵混合固体充分搅拌溶解,采取蒸发浓缩、冷却结晶过滤、洗涤、干燥得到较为摩尔盐晶体;
(4)用滴定法测定摩尔盐产品中Fe2+的含量:称取摩尔盐样品,溶于水,加入适量稀硫酸,用KMnO4溶液滴定,滴定过程中,左手控制酸式滴定管的活塞,右手摇动锥形瓶,直到溶液出现浅紫色且半分钟内不褪色时停止滴定,读数,根据5Fe2+~~MnO4-,由高锰酸钾的消耗可得样品中亚铁离子的量,据此可得.
解答 解:(1)Na2CO3溶液中CO32-水解CO32-+H2O?HCO3-+OH-,使平衡右移,增强溶液碱性;配制100g10%的Na2CO3溶液需要的仪器有药匙、量筒、烧杯、玻璃棒和天平;
故答案为:使平衡CO32-+H2O?HCO3-+OH-右移,增强溶液碱性;天平;
(2)为防止产生Fe3+,保证所制摩尔盐的纯度,步骤2中铁过量;
故答案为:为防止产生Fe3+,保证所制摩尔盐的纯度;
(3)硫酸亚铁溶液,加入硫酸铵混合固体充分搅拌溶解,采取蒸发浓缩、冷却结晶过滤、洗涤、干燥得到较为摩尔盐晶体;
故答案为:冷却结晶;
(4)①高锰酸根氧化亚铁离子为铁离子,自身被还原为锰离子,离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
②假设4.0产品中Fe2+的物质的量为xmol,则:
5Fe2+~~MnO4-,
5 1
xmol 0.01L×0.2mol/L
则x=0.01mol,产品中Fe2+的质量为0.01mol×56g/mol=0.56g,产品中Fe2+的质量分数为$\frac{0.56}{4}×100%$=14%;
故答案为:14%;
③滴定过程中,左手控制酸式滴定管的活塞,右手摇动锥形瓶,直到溶液出现浅紫色且半分钟内不褪色时停止滴定,读数;此时若俯视读数,高锰酸钾的体积读书偏小,测定结果将偏低;
故答案为:酸式滴定管的活塞;溶液出现浅紫色且半分钟内不褪色;低.
点评 本题以莫尔盐的制备为载体,考查涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解、氧化还原反应滴定应用以计算,题目难度中等.需学生具有扎实的基础知识与灵活运用知识解决问题的能力.


科目:高中化学 来源: 题型:实验题
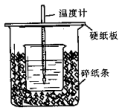 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,向0.1mol/L的醋酸中滴加相同浓度的氨水,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$一直减小 | |
| B. | 已知Ksp(BaSO4)=1.07×10-30,Ksp(BaCO3)=2.58×10-9,所以不能将BaSO4转化为BaCO3 | |
| C. | 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂 | |
| D. | 已知电离常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,则KCN溶液中通入少量CO2时的离子方程式为2CN-+H2O+CO2═2HCN+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知 0.2 mol•L-1的NaHSO3溶液中pH<7,则溶液中一定有:c(H2SO3)<c(SO32-) | |
| B. | 0.02 mol/L的NaOH溶液与0.02 mol/L的NaHC2O4溶液等体积混合液:2c(OH-)+c(C2O42-)=c(HC2O4-)+2c(H+) | |
| C. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 叠氮酸(HN3)与醋酸酸性相近,0.1 mol•L-1NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
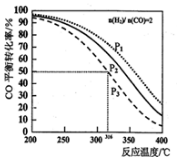
| A. | 上述反应△H<0 | |
| B. | 图中P1<P2<P3 | |
| C. | 若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆) | |
| D. | 若在P3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达到平衡时,CO转化率小于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 NaClO4溶液中所含ClO4-数目为NA | |
| B. | 标准状况下,11.2L CCl4所含极性键的数目为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 在0.1molNaHSO4晶体中,阳离子与阴离子总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=+90.3 | |
| B. | 恒温恒压下,在已达平衡的反应I体系中再充入少量He时平衡正向移动 | |
| C. | 其他条件不变,加压对反应Ⅱ的反应速率无影响 | |
| D. | 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com