
【题目】双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用 BMED膜堆(如图所示).模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜( a . d)。已知:在直流电源的作用下.双极膜内中间界面层发生水的解离,生成 H+ 和 OH-。下列说法正确的是
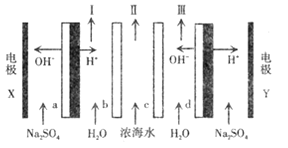
A.电极 Y连接电源的正极,发生还原反应
B.电解质溶液采用Na2SO4 溶液可避免有害气体的产生
C.I 口排出的是混合碱,II 口排出的是淡水
D.a左侧膜为阴离子交换膜 ,c 为阴离子交换膜
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是
A | B | C | D |
|
|
|
|
烧杯中产生白色沉淀,一段时间后沉淀无明显变化 | 加盐酸出现白色浑浊,加热变澄清 | KMnO4 酸性溶液在苯和甲苯中均褪色 | 液体分层,下层呈 无色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 增大压强,正逆反应的化学反应速率都减小
C. 升高温度, 正反应化学反应速率增大, 逆反应化学反应速率减小
D. 对该反应来说,无论反应进行到何时,混合气体的总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铜易溶于水,在130'℃时会发生分解反应,是一种燃烧催化剂,以食盐等为原料制备高氯酸铜 [ Cu(ClO4)26 H2O) ]的一种工艺流程如下:
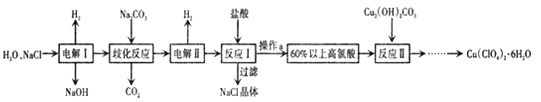
回答下列问题
(1)“电解I”的化学方程式为_________,所用交换膜是_(填“阳离子交换膜或“阴离子交换膜”) 。
(2)歧化反应是同一种物质中同种元素(自身氧化还原反应 ,已知上述工艺流程中“歧化反应”的产物之一为 NaClO3
①“歧化反应”的化学方程式为_。
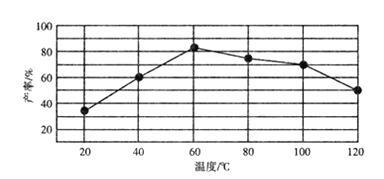
②“歧化反应”阶段不同温度对产率影响的结果如图所示。则该反应最适宜的温度是______。
(3)“电解II”的阳极产物为 ______(填离子符号).
(4) 该流程中可循环利用的物质是 _________(填化学式) 。
(5) 用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为a千克。 最终制得的Cu( ClO4)2 6 H2O为b千克.则产率为_____(用含a、 b 的代数式表示) 。
(6) 某温度下 ,高氯酸铜可按A、B 两种方式同时分解.分解过程中铜的化合价不发生改变。A方式为Cu( ClO4)2![]() CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).
CuCl2+4O2↑按A、B两种方式分解的高氯酸铜的量相同时.转移的电子数之比为8:7 , 则B方式 为__________ (用化学方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl36H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在冶金工业中,常以C作为还原剂,如温度高于980 K时,氧化产物以CO为主,低于980 K时以CO2为主。
(1)已知2CO(g)![]() CO2(g)+C(s),T=980 K时ΔH-TΔS=0。当体系温度低于980 K时,估计ΔH-TΔS________0(选填“大于”、“小于”或“等于”);当体系温度高于980 K时,该反应________自发进行(填“能”或“不能”)。
CO2(g)+C(s),T=980 K时ΔH-TΔS=0。当体系温度低于980 K时,估计ΔH-TΔS________0(选填“大于”、“小于”或“等于”);当体系温度高于980 K时,该反应________自发进行(填“能”或“不能”)。
(2)电子工业中清洗硅片上的SiO2(s)的反应为:
SiO2(s)+4HF(g)===SiF4(g)+2H2O(g)
ΔH(298.15 K)=-94.0 kJ·mol-1
ΔS(298.15 K)=-75.8 J·mol-1·K-1。
设ΔH和ΔS不随温度变化而变化,则此反应自发进行的温度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×101 | 1.7×105 | 6.2×1010 | K1=4.3×107 K2=5.6×1011 |
回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为________(填字母)。
(3)常温下,0.1 mol·L1的CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是________(填序号)
A.[H+] B.[H+]/[CH3COOH]
C.[H+]·[OH] D.[OH]/[H+]
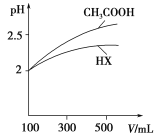
(4)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)写出少量CO2通入次氯酸钠溶液中的离子方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2俗名称作光气,是有毒气体。在一定条件下,可发生的化学反应为:COCl2(g) ![]() CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
CO(g)+Cl2(g) ΔH<0 下列有关说法不正确的是
A. 在一定条件下,使用催化剂能加快反应速率
B. 当反应达平衡时,恒温恒压条件下通入Ar,COCl2的转化率不变
C. 单位时间内生成CO和消耗Cl2的物质的量比为1∶1时,反应达到平衡状态
D. 平衡时,其他条件不变,升高温度可使该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)实验室在配制 FeSO4溶液时为了防止 FeSO4溶液变质,经常向其中加入铁粉,其原因是______________(用离子方程式表示)。
(2)向FeSO4溶液中滴加氨水的现象为 ______________________,请用化学用语解释出现此现象的原因___________________;_____________________
(3)现有配制所得的 100mL 6mol/L FeSO4溶液,往其中滴入一定量稀硝酸,请回答下列问题:
①配平该反应的离子方程式:____Fe2+____NO3-+____H+ = ___Fe3++____NO↑+_____H2O(在横线上写上化学计量数)
②要检验该反应后的溶液中是否还含有 Fe2+,可选用下列的一种试剂为_______
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③写出上述②的具体实验方案(含操作、现象、结论):____________________。
④经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下)____________________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com