
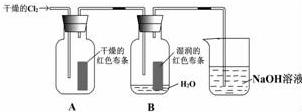
 某同学设计了如图的实验:
某同学设计了如图的实验:分析 (1)依据氯气是黄绿色气体,密度大于空气密度,有毒的物理性质解答;
(2)氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,据此解答;
(3)氯气有毒,直接排放到空气中容易造成空气污染,氯气能够与氢氧化钠溶液反应,被氢氧化钠溶液吸收,二者反应生成氯化钠、次氯酸钠和水;
(4)三价铁离子遇到KSCN溶液显血红色,三价铁离子与铁反应生成二价铁离子.
解答 解:(1)氯气是黄绿色气体,密度大于空气密度,氯气泄露,向地势高处转移,故答案为:黄绿;B;
(2)氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性,所以装置中通入Cl2后,集气瓶 A中干燥的红色布条无变化,集气瓶B中湿润的红色布条褪色;
故答案为:褪色; 干燥Cl2没有漂白性,Cl2与水反应生成 HClO有漂白性;
(3)氯气有毒,直接排放到空气中容易造成空气污染,氯气能够与氢氧化钠溶液反应,被氢氧化钠溶液吸收,二者反应生成氯化钠、次氯酸钠和水,反应方程式:Cl2+2NaOH═NaCl+NaClO+H2O;
故答案为:吸收尾气,防止污染空气; Cl2+2NaOH═NaCl+NaClO+H2O;
(4)三价铁离子遇到KSCN溶液显血红色,通常用KSCN溶液检验三价铁离子,三价铁离子与铁反应生成二价铁离子,离子方程式:2Fe3++Fe=3Fe2+;
故答案为:溶液变为红色; 2Fe3++Fe=3Fe2+.
点评 本题考查了元素化合物知识,明确氯气、氯水的成分及性质是解题关键,注意三价铁离子、二价铁离子的影响,题目难度不大.


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

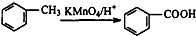
 .
. .
.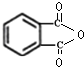 .
.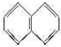 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
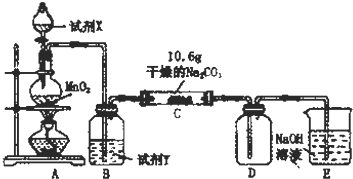
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,证明固体中含有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
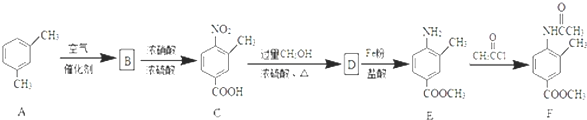
 ;由D→E的反应类型是还原反应.
;由D→E的反应类型是还原反应. .
. .
.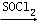 RCOCl.请写出以CH3CH2OH、
RCOCl.请写出以CH3CH2OH、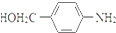 为原料,制备化合物
为原料,制备化合物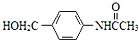 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C═CH2
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C═CH2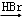 CH3CH2Br
CH3CH2Br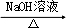 CH3CH2OH.
CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
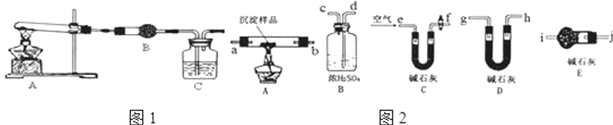
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
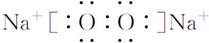 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子. ,写出该反应的化学方程式IBr+H2O=HBr+HIO.
,写出该反应的化学方程式IBr+H2O=HBr+HIO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com