
| A. | CS2为V形的极性分子 | |
| B. | ClO3-的空间构型为平面三角形 | |
| C. | SF6中所有原子均满足8电子稳定结构 | |
| D. | SiF4和SO32-的中心原子均为印sp3杂化 |
分析 A.CS2与CO2分子构型相同,根据二氧化碳的分子结构分析;
B.先求出中心原子的价层电子对数,再判断分子构型;
C.化合物分子中某原子最外层电子数=元素原子最外层电子数+该元素原子化合价绝对值,若该值等于8,则该原子满足8电子结构;
D.先求出中心原子的价层电子对数,再判断杂化类型.
解答 解:A.CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,属于直线形分子,故A错误;
B.ClO3-中Cl的价层电子对数=3+$\frac{7+1-2×3}{2}$=4,含有一个孤电子对,则离子的空间构型为三角锥形,故B错误;
C.SF6中S元素化合价为+6,S原子最外层电子数是6,6+6=12,分子中S原子不满足8电子结构,故C错误;
D.SiF4中Si的价层电子对数=4+$\frac{4-1×4}{2}$=4,SO32-中S的价层电子对数=3+$\frac{6+2-2×3}{2}$=4,所以中心原子均为sp3杂化,故D正确;
故选D.
点评 本题考查分子的构型、原子杂化方式判断等知识点,侧重考查基本理论,难点是判断原子杂化方式,孤电子对个数的计算为易错点.


科目:高中化学 来源: 题型:解答题
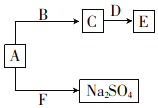 已知五种短周期元素在周期表中的相对位置如表所示.
已知五种短周期元素在周期表中的相对位置如表所示.| a | |||||
| b | |||||
| c | d | e |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
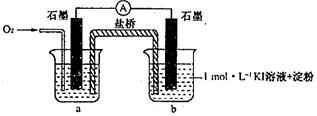
科目:高中化学 来源: 题型:实验题
| 序号 | 烧杯中的液体 | 5分钟后现象 |
| ① | 2mL 1mol•L-1KI溶液+5滴淀粉 | 无明显变化 |
| ② | 2mL1mol•L-1KI 溶液+5 滴淀粉+2mL0.2mol•L-1HC1 | 溶液变蓝 |
| ③ | 2mLl mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1KC1 | 无明显变化 |
| ④ | 2mL1mol•L-1KI溶液+5滴淀粉+2mL0.2mol•L-1CH3COOH | 溶液变蓝,颜色 较②浅 |
| 序号 | 烧杯中的液体 | 5小时后现象 |
| ⑤ | 2mL混有KOH的pH=8.5的lmol•L-1KI溶液+5滴淀粉 | 溶液略变蓝 |
| ⑥ | 2mL混有KOH的pH=10的lmol•L-1KI溶液+5滴淀粉 | 无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g18O2含有的中子数为10NA | B. | 1.9g1H37Cl含有的电子数为0.9NA | ||
| C. | lmolN2中共用电子对数为3NA | D. | 0.5molNH4+含有的质子数为5.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
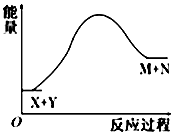
| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X和Y的总能量一定低于M和N的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
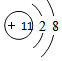 ;
; ,该物质属于离子(离子、共价)化合物,该物质溶于水会破坏离子键(离子键、共价键).
,该物质属于离子(离子、共价)化合物,该物质溶于水会破坏离子键(离子键、共价键). ,该物质属于共价(离子、共价)化合物,该物质在受热气化时化学键没有(有、没有)遭到破坏.
,该物质属于共价(离子、共价)化合物,该物质在受热气化时化学键没有(有、没有)遭到破坏.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com