
| A、一定温度下的可逆反应,只有达到平衡时才具有平衡常数 |
| B、化学平衡移动时,平衡常数一定改变 |
| C、化学平衡常数大的可逆反应,所有反应物的转化率一定大 |
| D、对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 |


科目:高中化学 来源: 题型:
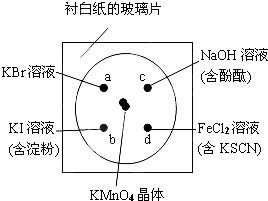 所谓微型化学实验就是以尽可能少的化学试剂获取所需化学信息的实验方法与技术.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度均为0.1mol/L的KBr溶液、KI溶液(含淀粉)、NaOH溶液(含酚酞)、FeCl2溶液(含KSCN)各一滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向晶体上滴加一滴浓盐酸,再立即将表面皿盖好.
所谓微型化学实验就是以尽可能少的化学试剂获取所需化学信息的实验方法与技术.某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度均为0.1mol/L的KBr溶液、KI溶液(含淀粉)、NaOH溶液(含酚酞)、FeCl2溶液(含KSCN)各一滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向晶体上滴加一滴浓盐酸,再立即将表面皿盖好.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用坩埚钳夹住铁丝在酒精灯上加热红热,迅速伸进氧气瓶中,燃烧火星四射,放出大量的热,生成红棕色的固体 |
| B、相同物质的量的钠在常温和加热的条件下与氧气反应所得的产物不同,但转移的电子数相同. |
| C、钠可以与冷水反应生成碱和氢气,铁必须与水蒸气反应才能生成碱和氢气 |
| D、等物质的量的铝分别与足量的盐酸和NaOH溶液反应生成相同条件下 氢气的体积比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、恒容,充入H2,I2百分含量降低 |
| B、恒温,压缩体积,平衡不移动,颜色加深 |
| C、恒容,升温,正反应速率减小 |
| D、恒压,充入HI,开始时正反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Ac-)>c(Cl-)>c(H+)>c(HAc) |
| B、c(Ac-)>c(Cl-)>c(HAc)>c(H+) |
| C、c(Ac-)=c(Cl+)>c(H+)>c(HAc) |
| D、c(Na+)+c(H+)=c(Ac-)+c(Cl-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硫能使紫色石蕊试液变红,说明二氧化硫水溶液呈酸性 |
| B、二氧化硫能漂白某些物质,说明二氧化硫具有氧化性 |
| C、二氧化硫能使溴水褪色,说明二氧化硫具有漂白性 |
| D、二氧化硫能用浓硫酸干燥,说明二氧化硫不具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、负极反应式:Ag+Cl-+e-═AgCl |
| B、电池的正极用二氧化锰纳米棒为材料,可大大提高发电效率 |
| C、Na+不断向“水”电池的负极移动 |
| D、每转移2 mol电子,正极就有5 mol MnO2被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 |
| B、除去CO2中混有的HCl:用饱和NaHCO3溶液洗气 |
| C、除去BaCO3固体中混有的BaSO4:加入过量的盐酸、过滤、洗涤 |
| D、除去乙炔中混有的少量H2S、PH3:通过CuSO4溶液后,洗气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com