
| A. | 对于C2H4(g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1mol,则用分压表示的平衡常数kP=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为4nol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
分析 A,分压=总压×物质的量分数,用分压表示的平衡常数kP=$\frac{{P}_{({C}_{2}{H}_{5}OH)}}{{P}_{({H}_{2}O)}•{P}_{({C}_{2}{H}_{4})}}$=$\frac{P•\frac{1}{3}}{P•\frac{1}{3}•P•\frac{1}{3}}$=$\frac{3}{P}$,故A,正确.
| B, | 考查等效平衡,恒温恒压下,在一容积可变的容器中,达到平衡时,A、B和C的物质的量分别为4nol、2mol和4mol,若此时A、B和C增加为4nol:2mol:4mol=2:1:2时,与原平衡一样,但此时A、B和C均增加1mol,拆成A、B和C的物质的量分别为1nol、0.5mol和1mol以及0.5molB.即在原平衡加0.5molB 平衡正向移动.故B,正确. |
| D, | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数只与温度有关,但用平衡分压表示的平衡常数是与温度和压强有关.故D,错误. |
解答 解:A,分压=总压×物质的量分数,用分压表示的平衡常数kP=$\frac{{P}_{({C}_{2}{H}_{5}OH)}}{{P}_{({H}_{2}O)}•{P}_{({C}_{2}{H}_{4})}}$=$\frac{P•\frac{1}{3}}{P•\frac{1}{3}•P•\frac{1}{3}}$=$\frac{3}{P}$,故A,正确.
| B, | 平衡正向移动.故B,正确. |
| D, | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数只与温度有关,但用平衡分压表示的平衡常数是与温度和压强有关.故D,错误. |
点评 考查恒温恒压下容积可变的等效平衡;用平衡分压表示的平衡常数的计算;用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数的区别.


科目:高中化学 来源: 题型:选择题
| A. | ①②④③ | B. | ②④③① | C. | ②④① | D. | ③④① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| B. | pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.4mol•L-1CH3COOH溶液与0.2mol•L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
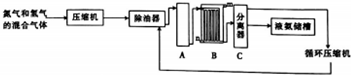
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<0,△H2>0 | B. | 0>△H3>△H4 | ||
| C. | 2△H5+△H1>0 | D. | △H1=△H2+△H3-2△H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
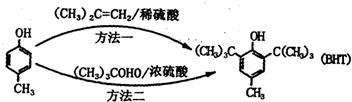
| A. | BHT在水中的溶解度小于苯酚 | |
| B. | 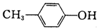 与BHT互为同系物 与BHT互为同系物 | |
| C. | 1molBHT可与含有2molBr2的浓溴水发生取代反应 | |
| D. | 方法一的原子利用率为100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com