
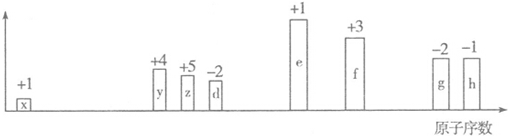
分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大;
(2)工业上电解饱和氯化钠溶液生成氢氧化钠;
(3)z的氢化物和h的氢化物反应形成化合物A为NH4Cl;
(4)铝盐溶液中铝离子水解为氢氧化铝胶体,可以用于净水;
(5)根据溶度积计算溶液中氢氧根离子浓度,进而计算氢离子浓度,再根据pH=-lgc(H+)计算;
(6)元素e和g组成的化合物B为Na2S,溶液中硫离子水解,溶液呈碱性,溶液中氢氧根离子源于硫离子水解、硫氢根水解、水的电离.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)y为碳元素,处于周期表中第二周期IVA族,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(N3-)>r(O2-)>r(Na+)>r(Al3+);
故答案为:第二周期IVA族;N3-;
(2)工业上电解饱和氯化钠溶液生成氢氧化钠,离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+Cl2↑+H2↑;
(3)z的氢化物和h的氢化物反应形成化合物A为NH4Cl,含有离子键、共价键,
故答案为:离子键、共价键;
(4)铝盐溶液中铝离子水解:Al3++3H2O=Al(OH)3(胶体)+3H+,生成氢氧化铝胶体,可以用于净水,
故答案为:Al3++3H2O=Al(OH)3(胶体)+3H+;
(5)Al3+沉淀时c(OH-)=$\root{3}{\frac{1.0×1{0}^{34}}{0.1}}$mol/L=10-11mol/L,则c(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,此时溶液pH=-lgc(H+)=3,
故答案为:3;
(6)元素e和g组成的化合物B为Na2S,溶液中硫离子水解,溶液呈碱性,溶液中氢氧根离子源于硫离子水解、硫氢根水解、水的电离,溶液中离子浓度大小为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),
故答案为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+).
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④⑤ | C. | ②③⑤⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤中含有苯及苯的同系物,可以通过干馏得到 | |
| B. | 煤是由有机物和无机物组成的复杂的混合物 | |
| C. | 乙烯是石油裂解后的产物 | |
| D. | 石油含有C5~C11的烷烃,可通过分馏得到汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E原子最外层有1个单电子,其次外层有3个能级且均排满电子;D与E同周期,价电子数为2.则:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 步骤I: ① . 步骤II:配制与0.1 mol/L Fe(NO3)3 溶液所含c (H+)、 c (NO3-) 相同的溶液,取适量此溶液放入到新制备的银镜中. | ② ,乙同学的推测 成立;反之,则不成立. |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 物质 | 杂质 | 所加试剂 | 分离方法 |
| (1) | NO | NO2 | ||
| (2) | Fe粉 | Al粉 | ||
| (3) | 氯化钠固体 | 氯化铵固体 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将作物秸秆通过化学反应转化为乙醇用作汽车燃料 | |
| B. | 使用资源节约型、环境友好型的生物降解塑料包装袋 | |
| C. | 大力研发新型有机溶剂替代水作为萃取剂 | |
| D. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com