
【题目】依据要求填空:
(1)羟基的电子式________________。
(2)![]() 含氧官能团的名称是________________。
含氧官能团的名称是________________。
(3)顺2丁烯的结构简式为________________。
(4)有机物![]() 按系统命名法命名为_________________________。
按系统命名法命名为_________________________。
(5) ![]() 的分子式为______________________。
的分子式为______________________。
(6)用系统命名法命名: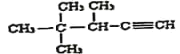 ____________________________。
____________________________。
【答案】![]() 羧基
羧基 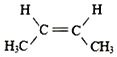 2,2,5―三甲基庚烷 C4H9ClO2 3,4,4―三甲基―1―戊炔
2,2,5―三甲基庚烷 C4H9ClO2 3,4,4―三甲基―1―戊炔
【解析】
(1)羟基的中心原子O周围7个电子,羟基中存在一对共用电子对;
(2) ![]() 中官能团的名称是羧基;
中官能团的名称是羧基;
(3) 顺2丁烯的结构简式为: 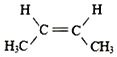 ;
;
(4) ![]() 中主链上有7个碳原子,2号位上有两个甲基,5号位上有一个甲基;
中主链上有7个碳原子,2号位上有两个甲基,5号位上有一个甲基;
(5) ![]() 中有4个碳原子,9个氢原子,1个氯原子,2个氧原子:C4H9ClO2;
中有4个碳原子,9个氢原子,1个氯原子,2个氧原子:C4H9ClO2;
(6) 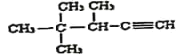 主链上有5个碳原子,从碳碳三键开始编号,3号位上有一个甲基,4号位上有两个甲基。
主链上有5个碳原子,从碳碳三键开始编号,3号位上有一个甲基,4号位上有两个甲基。
(1)羟基的中心原子O周围7个电子,羟基中存在一对共用电子对,羟基的电子式为:![]() ;
;
(2) ![]() 中官能团的名称是:羧基;
中官能团的名称是:羧基;
(3) 顺2丁烯的结构简式为: 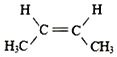 ;
;
(4) ![]() 中主链上有7个碳原子,2号位上有两个甲基,5号位上有一个甲基,则系统命名为:2,2,5―三甲基庚烷;
中主链上有7个碳原子,2号位上有两个甲基,5号位上有一个甲基,则系统命名为:2,2,5―三甲基庚烷;
(5) ![]() 中有4个碳原子,9个氢原子,1个氯原子,2个氧原子,该有机物的分子式为:C4H9ClO2;
中有4个碳原子,9个氢原子,1个氯原子,2个氧原子,该有机物的分子式为:C4H9ClO2;
(6) 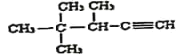 主链上有5个碳原子,从碳碳三键开始编号,3号位上有一个甲基,4号位上有两个甲基,系统命名法命名为:3,4,4―三甲基―1―戊炔。
主链上有5个碳原子,从碳碳三键开始编号,3号位上有一个甲基,4号位上有两个甲基,系统命名法命名为:3,4,4―三甲基―1―戊炔。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B.0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大
C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
D.若![]() LpH=11的NaOH溶液与
LpH=11的NaOH溶液与![]() LpH=3的HA溶液混合后显中性,则
LpH=3的HA溶液混合后显中性,则![]() ≤
≤![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10L0.1mol·L-1氨水与10L0.1mol·L-1盐酸混合:[Cl-]>[NH4+]>[OH-]>[H+]
B. 10mL0.1mol·L-1NH4Cl溶液与5mL0.2mol·L-1NaOH溶液混合:[Na+]=[Cl-]>[OH-]>[H+]
C. 10mL0.1mol·L-1CH3COOH溶液与5mL0.2mol·L-1NaOH溶液混合:[Na+]=[CH3COO-]>[OH-]>[H+]
D. 10mL0.5mol·L-1CH3COONa溶液与6mL1mol·L-1盐酸混合:[Cl-]>[Na+]>[OH-]>[H+]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 质子膜燃料电池工作原理如图。下列说法不正确的是
质子膜燃料电池工作原理如图。下列说法不正确的是![]()
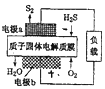
A.电池工作时,电流从电极b经过负载流向电极a
B.电极a上发生的电极反应式为![]()
C.电路中通过4mol电子时,4mol![]() 经质子膜进入正极区
经质子膜进入正极区
D.当反应生成64![]() 时,电池内部释放632kJ热量
时,电池内部释放632kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式,下列推断正确的是( )

A.②中所含官能团种类比③中多
B.①、④互为同系物
C.①、②、③、④均能使溴水褪色
D.等物质的量②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。
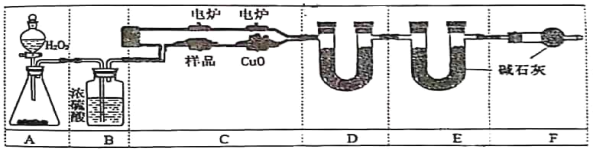
(1)B装置中浓H2SO4的作用是____________________
(2)装置D中所盛固体可以是__________(用对应符号填空)
a.生石灰 b. CaCl2 c. CuSO4 d. 碱石灰
(3)C中燃烧管中CuO的作用是_____________________________;
(4)F中干燥管中碱石灰的作用是___________________________;
(5)当C中有机物完全反应后还要继续通一段时间的氧气目的是____________;
(6)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,E管质量增加1.32g,D管质量增加0.54 g,经测定该有机物的质谱图中最大质荷比为60.0,该有机物的分子式为_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存和发展的重要物质基础,回答下列问题:
(1)下列生产工艺能获取新型无机非金属材料的是 ______ (填序号)。
①采用甲烷为原料,在微波和其他条件下生产金刚石
②采用传统方法用焦炭还原SiO2制备单晶硅
③在水泥生产过程中加入高炉矿渣生产特殊用途的水泥
④在玻璃生产过程中加入K、Pb生产其有特殊用途的光学玻璃
(2)某炼铁高炉中一次投入磁铁矿冶炼生铁,若该过程中转移的电子为1.60×105mol,不考虑其他的反应,也不考虑生铁中的杂质,则炼得的生铁为 ______t。生铁中含碳、硫等元素较多,炼钢是以生铁为原料,除去过多的碳、硫等杂质元素,其中除去硫的化学方程式为 ______。
(3)工业炼金属Al的工艺流程如下:
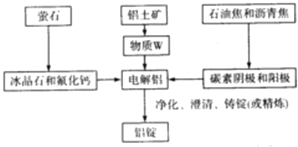
该工艺中冰晶石和氟化钙的作用是 ______,物质W的化学式为 ______ ;若铝土矿的纯度为60%,提取W的损失率为3%,电解时损失率为0.1%,粗铝净化时的损失率为2%,铝锭中铝的含量为99.9%,那么1.0t铝土矿可制备铝锭 ______t。
(4)金属腐蚀带来的损失无法估量。钢铁腐蚀多为吸氧腐蚀,其正极反应式为 ______,金属防腐措施很多,其中牺牲阳极(金属Zn)的阴极保护法的“阴极”反应式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L 密闭容器中充有2 mol SO2和一定量的O2,发生下列反应2SO2+O22SO3,假设反应过程中温度恒定,当反应进行到4 min时,测得SO2为0.4 mol,若反应进行到2 min时,密闭容器中SO2的物质的量为
A. 1.6 mol B. 1.2 mol C. 大于1.6 mol D. 小于1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
I.若碱性锌锰干电池的总反应为:2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)2 ,则该电池的正极反应式为:_________________________________
II.回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
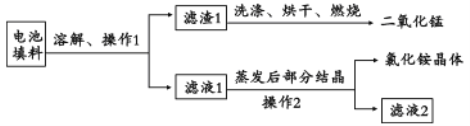
(1)① 操作中先将电池填料研碎的目的是:________________。操作l和操作2的名称都是___________,② 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
(3)部分难溶的电解质溶度积常数(Ksp)如下表:
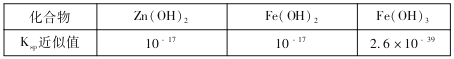
用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com