
���� 2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2mol B�������C��Ũ��Ϊ1.2mo1•L-1��v��B��=$\frac{\frac{2mol-1.2mol}{2L}}{2min}$=0.2mol/��L��min����v��C��=$\frac{1.2mol/L}{2min}$=0.6mol/��L��min�����ɷ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȿ�֪��x=6����
2A��g��+2B��g��?6C��g��+2D��g��
��ʼ 2 2 0 0
ת�� 0.8 0.8 2.4 0.8
ƽ�� 1.2 1.2 2.4 0.8
�Դ˿ɼ���ת���ʣ�
��4�������ݻ����䣬�����м���amolHe����Ӧ��ϵ�и����ʵ�Ũ�Ȳ��䣮
��� �⣺2minʱ��Ӧ�ﵽƽ��״̬����ʱʣ��1.2mol B�������C��Ũ��Ϊ1.2mo1•L-1��v��B��=$\frac{\frac{2mol-1.2mol}{2L}}{2min}$=0.2mol/��L��min����v��C��=$\frac{1.2mol/L}{2min}$=0.6mol/��L��min�����ɷ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȿ�֪��x=6����
2A��g��+2B��g��?6C��g��+2D��g��
��ʼ 2 2 0 0
ת�� 0.8 0.8 2.4 0.8
ƽ�� 1.2 1.2 2.4 0.8
��1�������������֪���ӿ�ʼ��Ӧ���ﵽƽ��״̬������C��ƽ����Ӧ����Ϊ0.6mol/��L��min�����ʴ�Ϊ��0.6mol/��L��min����
��2��x=6���ʴ�Ϊ��6��
��3��A��ת������B��ת����֮��Ϊ$\frac{0.8}{2}$��$\frac{0.8}{2}$=1��1���ʴ�Ϊ��1��1��
��4�����������ݻ����䣬�����м���amolHe����Ӧ��ϵ�и����ʵ�Ũ�Ȳ��䣬��÷�Ӧ������Ӧ����Ϊ���䣬ƽ�⽫���ƶ����ʴ�Ϊ�����䣻���ƶ���
���� ���⿼�黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬���ջ�ѧƽ�����η���ת���ʼ����Ϊ���Ĺؼ������ط�������������Ŀ��飬ע�⻯ѧ���������жϣ���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ȼֲ���ͳ�����һ���Һ̬��������ˮ��û�к㶨���۵㡢�е� | |
| B�� | ��ȩ������������Ƕ��������Ƶ�Cu��OH��2��Ӧ���ҷ�Ӧ���;�Ϊ������Ӧ | |
| C�� | ��ȩ������ϩ���Ҷ���������Ϊ�ϳɾۺ���ĵ��� | |
| D�� | ʯ�ʹ��ѻ�����ҪĿ����������͵������͵IJ�����������ʯ���ѽ����ҪĿ���ǵõ��������ϩ����ϩ����̬������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ijʵ��С����0.50mol/L NaOH��Һ��0.50mol/L H2SO4��Һ�����к��ȵIJⶨ��
ijʵ��С����0.50mol/L NaOH��Һ��0.50mol/L H2SO4��Һ�����к��ȵIJⶨ��| ���� | ������ƽ�������룩 | С�ձ� | ����ǯ | ������ | ҩ�� | ��Ͳ |
| ���� |  |  |  |  |  |  |
| ��� | a | b | c | d | e | f |
| ʵ����� �¶� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | ƽ���¶Ȳ� ��t2-t1��/�� | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
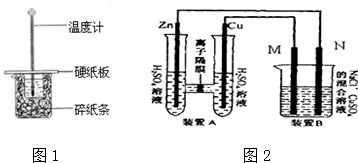
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ${\;}_{8}^{17}O$ԭ�Ӻ��ں���8������ | B�� | ${\;}_{8}^{17}O$ԭ�Ӻ��ں���8������ | ||
| C�� | ${\;}_{8}^{17}O$ԭ�Ӻ�����17������ | D�� | ${\;}_{8}^{17}O$ԭ�Ӻ��ں���17������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
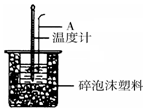 50mL 0.50mol/L�����50mL 0.55mol/L NaOH��Һ����ͼ��ʾ��װ�� �н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ��㷴Ӧ�ȣ�
50mL 0.50mol/L�����50mL 0.55mol/L NaOH��Һ����ͼ��ʾ��װ�� �н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ��㷴Ӧ�ȣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
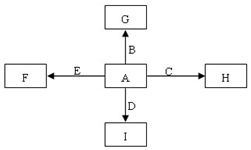 ͼ�У�A��B��C��D��E�ǵ��ʣ�G��H��I��F��B��C��D��E�ֱ��A�γɵĶ�Ԫ�������֪���ٷ�ӦC+G$\stackrel{����}{��}$B+H�ܷų��������ȣ��÷�Ӧ��Ӧ��������ĺ��ӣ�
ͼ�У�A��B��C��D��E�ǵ��ʣ�G��H��I��F��B��C��D��E�ֱ��A�γɵĶ�Ԫ�������֪���ٷ�ӦC+G$\stackrel{����}{��}$B+H�ܷų��������ȣ��÷�Ӧ��Ӧ��������ĺ��ӣ� �����Ŀռ乹����ֱ���ͣ�
�����Ŀռ乹����ֱ���ͣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
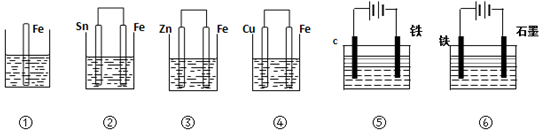
| A�� | �ܣ��ڣ��٣��ۣ��ݣ��� | B�� | �ޣ��ܣ��ڣ��٣��ۣ��� | C�� | �ܣ��ڣ��ݣ��ۣ��ޣ��� | D�� | �ޣ��ۣ��ڣ��ܣ��٣��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Co2O3+6HCl=2CoCl2+Cl2��+3H2O�У��������ͻ�ԭ�����ʵ���֮��Ϊ1��6 | |
| B�� | 5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O�У���������ͻ�ԭ�������ʵ���֮��Ϊ5��1 | |
| C�� | 3S8+24KOH=8K2SO3+4K2S4+12H2O�У��������ͱ���ԭ��S8���ʵ���֮��Ϊ2��1 | |
| D�� | 3��NH4��2SO4=3SO2+N2+6H2O+4NH3�У���Ӧ�з���������Ӧ��δ����������Ӧ�ĵ�Ԫ�����ʵ���֮��Ϊ2��1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com