
| ŹµŃ鱹ŗÅ | ¢Ł | ¢Ś | ¢Ū | ¢Ü |
| Ļ”ĻõĖįĢå»ż£ØmL£© | 100 | 200 | 300 | 400 |
| Ź£Óą½šŹōÖŹĮæ£Øg£© | 9.0 | 4.8 | 0 | 0 |
| NOĢå»ż£ØL£© | 1.12 | 2.24 | 3.36 | 4.48 |
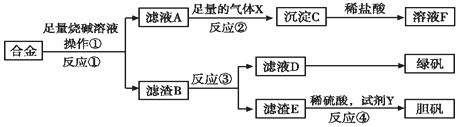
·ÖĪö øł¾Ż½šŹōµÄŠŌÖŹ½įŗĻæņĶ¼×Ŗ»Æ¹ŲĻµŗĶĖłµĆ²śĘ·Ń”ŌńŗĻŹŹµÄŹŌ¼Į£®ÓÉĀĖŅŗA”śČÜŅŗF£ØAlCl3£©æÉÖŖ£¬ĀĖŅŗAÖŠŗ¬ÓŠČܽāµÄĀĮŌŖĖŲ£¬øł¾ŻĀĮ¼ČÓėĖį·“Ó¦ÓÖÓė¼ī·“Ó¦æÉÖŖ£¬ĀĮÓėĒāŃõ»ÆÄĘČÜŅŗ·“Ó¦£®Ģś”¢ĶÓėĒāŃõ»ÆÄĘ²»·“Ó¦£¬ĖłŅŌĀĖŌüBĪŖĢś”¢Ķ£®øł¾Ż²śĘ·ĀĢ·Æ£¬·“Ó¦¢ŪĪŖĻ”ĮņĖįÓėĢś·“Ó¦£¬ĖłŅŌĀĖŅŗEĪŖĮņĖįŃĒĢśČÜŅŗ£¬ĀĖŌüFĪŖĶ£®Ķµ½ĮņĖįĶ£¬æÉÓĆÅØĮņĖįÓėĶ¼ÓČČÖĘČ”£¬µ«»į²śÉśĪŪČ¾ĘųĢ嶞Ńõ»ÆĮņ£¬ĖłŅŌ²ÉÓĆĶÓė¹żŃõ»ÆĒāŗĶĮņĖįŅ»Ęš·“Ӧɜ³ÉĮņĖįĶµÄ·½·Ø£®
£Ø1£©½ųŠŠ¹żĀĖ²Ł×÷Ź±£¬ĖłÓƵ½µÄ²£Į§ŅĒĘ÷Ö÷ŅŖÓŠÉÕ±”¢Ā©¶·”¢²£Į§°ō£»
£Ø2£©½šŹōĀĮæÉŅŌŗĶĒæ¼ī·¢Éś·“Ӧɜ³ÉĘ«ĀĮĖįŃĪŗĶĒāĘų£»Ę«ĀĮĖįŃĪæÉŅŌŗĶ¶žŃõ»ÆĢ¼ĘųĢå·“Ó¦Éś³ÉĒāŃõ»ÆĀĮ³Įµķ£»
£Ø3£©øł¾ŻŃĒĢśĄė×ӵļģŃé·½·ØĄ“»Ų“š£»
£Ø4£©Ė«ŃõĖ®ŹĒŅ»ÖÖĀĢÉ«Ńõ»Æ¼Į£¬æÉŅŌŹµĻÖ½šŹōĶŗĶĮņĖįÖ®¼äµÄ·“Ó¦£»
£Ø5£©ŌŚĀĖŌüBÖŠµĪ¼ÓŃĪĖįŹ±£¬ČÜŅŗÖŠĶ”¢ĢśÓėŃĪĖįŠĪ³ÉĮĖŌµē³Ų£»
£Ø6£©¼ÓČė100mLĻõĖįŹ±£¬½šŹōÓŠŹ£Óą£¬ĖµĆ÷½šŹōČܽāÉś³É¶ž¼ŪĄė×ÓĒŅĻõĖįĶźČ«·“Ӧɜ³ÉĻõĖįŅųŗĶNO£¬n£ØNO£©=$\frac{1.12L}{22.4L/mol}$=0.05mol£¬Éś³ÉNOŗĶĻūŗÄĻõĖįÖ®¼äµÄ¹ŲĻµŹ½ĪŖ2NO----8HNO3£¬¾Ż“Ė¼ĘĖćĻõĖįÅØ¶Č£»
¢Ś100-200mLŹ±£¬Čܽā½šŹōÖŹĮæ=9.0g-4.8g=4.2g£¬½šŹōÓŠŹ£Óą£¬ĖµĆ÷Éś³ÉµÄ½šŹōŃōĄė×ÓŹĒ¶ž¼ŪĢśĄė×Ó£¬Ōö¼Ón£ØNO£©=$\frac{2.24-1.12}{22.4}$=0.05mol£¬øł¾Ż×ŖŅʵē×ÓŹŲŗćµĆn£Ø½šŹō£©=$\frac{0.05mol”Į£Ø5-2£©}{2-0}$=0.075mol£¬½šŹōĘ½¾łÄ¦¶ūÖŹĮæ=$\frac{4.2g}{0.075mol}$=56g/mol£¬ĖłŅŌČܽāµÄŹĒFe£»ĒŅ0-100mLČܽāµÄĢśŗĶ100-200mLČܽāµÄĢśÖŹĮæĻąµČ£¬ĖłŅŌ0-100mLČܽāµÄFeĪŖ8.4g£»200-300mLŹ±£¬Čܽā½šŹōÖŹĮæ=4.8-0=4.8£¬Ōö¼Ón£ØNO=0.05mol¼ŁÉčČܽāµÄĶźČ«ŹĒĶ£¬
øł¾Ż×ŖŅʵē×ÓŹŲŗćµĆn£Ø½šŹō£©=$\frac{0.05mol”Į£Ø5-2£©}{2-0}$=0.075mol£¬½šŹōĘ½¾łÄ¦¶ūÖŹĮæ=$\frac{4.8g}{0.075mol}$=64g/mol£»
½ā“š ½ā£ŗ£Ø1£©²Ł×÷¢Ł¹żĀĖ£¬ĀĖ²Ł×÷Ź±£¬ĖłÓƵ½µÄ²£Į§ŅĒĘ÷Ö÷ŅŖÓŠÉÕ±”¢Ā©¶·”¢²£Į§°ō£»¹Ź“š°øĪŖ£ŗÉÕ±”¢Ā©¶·”¢²£Į§°ō£»
£Ø2£©¢Ł½šŹōĀĮæÉŅŌŗĶĒæ¼īĒāŃõ»ÆÄĘ·¢Éś·“Ӧɜ³ÉĖÄōĒ»łŗĻĀĮĖįÄĘŗĶĒāĘų£¬¼“2Al+2NaOH+6H2O=2Na[Al£ØOH£©4]+3H2”ü£¬¹Ź“š°øĪŖ£ŗ2Al+2NaOH+6H2O=2Na[Al£ØOH£©4]+3H2”ü£»
¢ŚĖÄōĒ»łŗĻĀĮĖįÄĘÖŠĶØČė¶žŃõ»ÆĢ¼£¬ŌņæÉŅŌŗĶ¶žŃõ»ÆĢ¼ĘųĢå·“Ó¦Éś³ÉĒāŃõ»ÆĀĮ³Įµķ£¬¼“[Al£ØOH£©4]-+CO2ØTAl£ØOH£©3”ż+HCO3-£¬¹Ź“š°øĪŖ£ŗ[Al£ØOH£©4]-+CO2ØTAl£ØOH£©3”ż+HCO3-£»
£Ø3£©ŃĒĢśĄė×ÓæÉŅŌŗĶĒæ¼ī·“Ӧɜ³ÉĒāŃõ»ÆŃĒĢś³Įµķ£¬ŃøĖŁ±»Ńõ»ÆĪŖĒāŃõ»ÆĢś£¬¹ŹŃĒĢśĄė×ӵļģŃé·½·Ø£ŗȔɣĮæĀĖŅŗD¼ÓČėNaOHČÜŅŗ£¬²śÉś°×É«³Įµķ£¬³ĮµķŃøĖŁ±ä³É»ŅĀĢÉ«£¬×īŗó±ä³ÉŗģŗÖÉ«£¬¹Ź“š°øĪŖ£ŗȔɣĮæĀĖŅŗD¼ÓČėNaOHČÜŅŗ£¬²śÉś°×É«³Įµķ£¬³ĮµķŃøĖŁ±ä³É»ŅĀĢÉ«£¬×īŗó±ä³ÉŗģŗÖÉ«£»
£Ø4£©Ė«ŃõĖ®ŹĒŅ»ÖÖĀĢÉ«Ńõ»Æ¼Į£¬ŌŚĖ«ŃõĖ®µÄ×÷ÓĆĻĀ£¬½šŹōĶæÉŅŌŗĶĮņĖį·¢Éś·“Ó¦£ŗCu+H2O2+H2SO4+3H2O=CuSO4•5H2O»ņCu+H2O2+H2SO4=CuSO4+2H2O£¬¹Ź“š°øĪŖ£ŗCu+H2O2+H2SO4+3H2O=CuSO4•5H2O»ņCu+H2O2+H2SO4=CuSO4+2H2O£»
£Ø5£©ŌŚĀĖŌüBÖŠµĪ¼ÓŃĪĖįŹ±£¬ČÜŅŗÖŠĶ”¢ĢśÓėŃĪĖįŠĪ³ÉĮĖŠķ¶ąĪ¢Š”µÄŌµē³Ų£¬¹¹³ÉĮĖµē»ÆѧøÆŹ“£¬¼ÓæģĮĖ·“Ó¦ĖŁĀŹ£¬¹Ź“š°øĪŖ£ŗĶ”¢ĢśÓėĻ”ĮņĖįŠĪ³ÉĮĖŌµē³Ų£»
£Ø6£©¼ÓČė100mLĻõĖįŹ±£¬½šŹōÓŠŹ£Óą£¬ĖµĆ÷½šŹōČܽāÉś³É¶ž¼ŪĄė×ÓĒŅĻõĖįĶźČ«·“Ӧɜ³ÉĻõĖįŅųŗĶNO£¬n£ØNO£©=$\frac{1.12L}{22.4L/mol}$=0.05mol£¬Éś³ÉNOŗĶĻūŗÄĻõĖįÖ®¼äµÄ¹ŲĻµŹ½ĪŖ2NO----8HNO3£¬c£ØHNO3£©=$\frac{n}{V}$=$\frac{0.05”Į4}{0.1}$=2mol/L£¬
¹Ź“š°øĪŖ£ŗĻõĖįµÄÅضČĪŖ2mol/L£»
¢Ś100-200mLŹ±£¬Čܽā½šŹōÖŹĮæ=9.0g-4.8g=4.2g£¬½šŹōÓŠŹ£Óą£¬ĖµĆ÷Éś³ÉµÄ½šŹōŃōĄė×ÓŹĒ¶ž¼ŪĢśĄė×Ó£¬Ōö¼Ón£ØNO£©=$\frac{2.24-1.12}{22.4}$=0.05mol£¬øł¾Ż×ŖŅʵē×ÓŹŲŗćµĆn£Ø½šŹō£©=$\frac{0.05mol”Į£Ø5-2£©}{2-0}$=0.075mol£¬½šŹōĘ½¾łÄ¦¶ūÖŹĮæ=$\frac{4.2g}{0.075mol}$=56g/mol£¬ĖłŅŌČܽāµÄŹĒFe£»ĒŅ0-100mLČܽāµÄĢśŗĶ100-200mLČܽāµÄĢśÖŹĮæĻąµČ£¬ĖłŅŌ0-100mLČܽāµÄFeĪŖ8.4g£»200-300mLŹ±£¬Čܽā½šŹōÖŹĮæ=4.8-0=4.8£¬Ōö¼Ón£ØNO=0.05mol¼ŁÉčČܽāµÄĶźČ«ŹĒĶ£¬
øł¾Ż×ŖŅʵē×ÓŹŲŗćµĆn£Ø½šŹō£©=$\frac{0.05mol”Į£Ø5-2£©}{2-0}$=0.075mol£¬½šŹōĘ½¾łÄ¦¶ūÖŹĮæ=$\frac{4.8g}{0.075mol}$=64g/mol£¬ĖłŅŌČܽāµÄĶźČ«ŹĒCu£¬ĖłŅŌ¢ŪÖŠČܽāµÄCuµÄÖŹĮæĪŖ4.8g£¬
¹Ź“š°øĪŖ£ŗ¢ŪÖŠČܽāµÄCuµÄÖŹĮæĪŖ4.8g£®
µćĘĄ ±¾ĢāĪŖÉś²śĮ÷³ĢĢā£¬Éę¼°½šŹōµÄ»ŲŹÕ”¢»·¾³±£»¤”¢Ńõ»Æ»¹Ō·“Ó¦”¢ĪļÖŹµÄ·ÖĄėĢį“æŗĶ³żŌÓµČĪŹĢā£¬ĢāÄæ½ĻĪŖ×ŪŗĻ£¬×öĢāŹ±×¢Ņā׊ĻøÉóĢā£¬“ÓĢāÄæÖŠ»ńČ”¹Ų¼üŠÅĻ¢£®±¾ĢāÄѶČÖŠ£®


 ø÷µŲĘŚÄ©ø“Ļ°ĢŲѵ¾ķĻµĮŠ“š°ø
ø÷µŲĘŚÄ©ø“Ļ°ĢŲѵ¾ķĻµĮŠ“š°ø Š”²©ŹæĘŚÄ©“³¹Ų100·ÖĻµĮŠ“š°ø
Š”²©ŹæĘŚÄ©“³¹Ų100·ÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Q Óė W²»ÄÜŠĪ³É 10µē×Ó”¢14µē×Ó”¢18 µē×Ó·Ö×Ó | |
| B£® | Y µÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄ»ÆѧŹ½Ö»ÄܱķŹ¾ĪŖ H4YO4 | |
| C£® | Y”¢Z”¢Q ·Ö±šÓė X »ÆŗĻ£¬Ö»ÄÜŠĪ³É AB2ŠĶ»ÆŗĻĪļ | |
| D£® | X”¢Z”¢W ÖŠµÄĮ½ÖÖ»ņČżÖÖŌŖĖŲŠĪ³ÉµÄÄĘŃĪČÜŅŗæÉÄÜĻŌĖįŠŌ”¢¼īŠŌ”¢ÖŠŠŌ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¾Ę¾«ŗĶĖ® | B£® | µāŗĶĖÄĀČ»ÆĢ¼ | C£® | Ė®ŗĶĖÄĀČ»ÆĢ¼ | D£® | »ģÓŠÄąĶĮµÄÕįĢĒ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ĘšŹ¼ÅØ¶Č | ¼× | ŅŅ | ±ū |
| c£ØNO2£©/mol•L-1 | 0.10 | 0.20 | 0.20 |
| c£ØSO2£©/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A£® | ČŻĘ÷¼×ÖŠµÄ·“Ó¦ŌŚĒ°2minµÄĘ½¾łĖŁĀŹv£ØSO2£©=0.05mol•L-1•min-1 | |
| B£® | “ļµ½Ę½ŗāŹ±£¬ČŻĘ÷±ūÖŠÕż·“Ó¦ĖŁĀŹÓėČŻĘ÷¼×ĻąµČ | |
| C£® | ĪĀ¶ČÉżÖĮ90”ę£¬ÉĻŹö·“Ó¦Ę½ŗā³£ŹżĪŖ1.56£¬Ōņ·“Ó¦µÄ”÷H£¾0 | |
| D£® | ČŻĘ÷ŅŅÖŠČōĘšŹ¼Ź±øijä0.10mol•L-1NO2ŗĶ0.20mol•L-1SO2£¬“ļµ½Ę½ŗāŹ±c£ØNO£©ÓėŌĘ½ŗā²»ĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
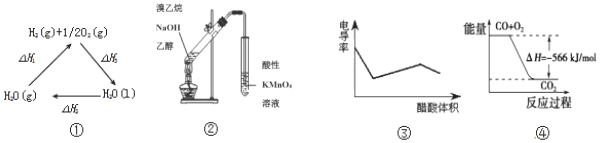
| A£® | Ķ¼¢ŁÖŠ”÷H1=”÷H2+”÷H3 | |
| B£® | Ķ¼¢ŚæÉÓĆÓŚÖ¤Ć÷ŹµŃéÖŠÉś³ÉĮĖŅŅĻ© | |
| C£® | Ķ¼¢Ū±ķŹ¾“×ĖįČÜŅŗµĪ¶Ø NaOH ŗĶ°±Ė®»ģŗĻČÜŅŗµÄµēµ¼ĀŹ±ä»ÆĒśĻß | |
| D£® | Ķ¼¢ÜæɱķŹ¾ÓÉCO£Øg£©Éś³ÉCO2£Øg£©µÄ¹ż³ĢÖŠŅŖ·Å³ö566kJ ČČĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µŚŅ»µēĄėÄÜ£ŗF£¾O£¾N | |
| B£® | Ąė×Ó¾§ĢåÖŠŅ»¶Ø“ęŌŚĄė×Ó¼ü | |
| C£® | CCl4ŗĶNH3¶¼ŹĒŅŌ¼«ŠŌ¼ü½įŗĻµÄ¼«ŠŌ·Ö×Ó | |
| D£® | °×Į×ĪŖ·Ö×Ó¾§Ģ壬·Ö×Ó½į¹¹ĪŖÕżĖÄĆęĢ壬Ęä¼ü½ĒĪŖ109.5”ć |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | S2Cl2µÄ½į¹¹Ź½ĪŖCl-S-S-Cl | |
| B£® | S2Cl2ÖŠSŌ×ÓµÄŌÓ»ÆĄąŠĶĪŖsp2ŌÓ»Æ | |
| C£® | S2Cl2·Ö×ÓÖŠø÷Ō×ÓŗĖĶā×īĶā²ćµē×Ó¾ł“ļµ½8µē×ÓĪČ¶Ø½į¹¹ | |
| D£® | S2Cl2ÓėH2O·“Ó¦µÄ»Æѧ·½³ĢŹ½æÉÄÜĪŖ£ŗ2S2Cl2+2H2OØTSO2”ü+3S”ż+4HCl |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com