
各类化合物与单质处于固态(晶体)时,构成晶体的粒子间必定存在一定形式的相互作用,粒子按一定规律在空间整齐排列,形成几何晶体。
(1)当构成晶体的粒子为阴、阳离子时,这种晶体称为 ,微粒间的作用是 ,由于这种作用较 ,一般说来,这种晶体有 的熔、沸点和 的硬度。
(2)当构成晶体的粒子为分子时,这种晶体称为 ,微粒间的作用是 ,由于这种作用 ,一般说来,这种晶体有较低的熔、沸点和 的硬度。
(3)当构成晶体的粒子为原子时,这种晶体称为 ,由于这种晶体的微粒之间全部以 结合,并形成一种 结构,故这种晶体具有 的熔、沸点 和 的硬度。
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
化学与科学、技术、社会、环境密切相关。下列说法不正确的是
A.用二氧化碳和环氧丙烷生产可降解高聚物有利于环境和生态
B.高温能杀死流感病毒是因为构成病毒的蛋白质受热变性
C.光导纤维的主要成分不是二氧化硅而是单晶硅
D.人体摄入油脂,在体内水解可得到高级脂肪酸和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明干燥氯气无漂白性以及卤素氧化性的强弱,可先制取氯气再进行性质实验。下图为实验所提供的仪器和药品,据此回答下列问题:

⑴各仪器装置连接的顺序为(填接口序号) 接 、 接 、
接 、 接 。
⑵装置Ⅰ中的现象是 ,发生反应的离子方程式为 ;
⑶仪器Ⅱ中分别加入的试剂为 和 。(按气体流向先后顺序填)
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C原子序数依次递增,它们原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是
A.原子半径A<B<C B.A的氢化物的稳定性大于C的氢化物的稳定性
C.C的氧化物的熔点比A的氧化物的低 D.A与C可形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃以任意比例混合,在150℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L,下列各组混合烃中不符合此条件的是( )
A. CH4 C2H4 B. CH4 C3H6 C. C2H4 C3H4 D. CH4 C3H4
查看答案和解析>>
科目:高中化学 来源: 题型:
在25℃时,将两个铜电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,
阴极逸出a mol气体,同时有w g Na2SO4·10H2O晶体析出,若温度不变,剩余溶液中
溶质质量分数是( )。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于苯酚的叙述不正确的是( )
A.苯酚是一种弱酸,滴加指示剂变色
B.苯酚在水溶液中能按下式电离:

C.苯酚钠在水溶液中几乎不能存在,会水解生成苯酚,所以苯酚钠溶液显碱性
D.苯酚有腐蚀性,溅在皮肤上可用酒精冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2 2NH3 △H= - 92.4kJ/mol
2NH3 △H= - 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
此温度下该反应的平衡常数K= 。
②欲提高H2的转化率,下列措施可行的是 。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
 d.液化生成物分离出氨
d.液化生成物分离出氨
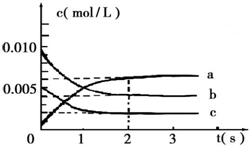
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g) 2NO2(g) △H<0体系中,各成分浓度随时间的变化如右图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如右图:
①用O2表示从0~2s内该反应的平均速率
v=___________。
②能说明该反应已经达到平衡状态的是
_________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
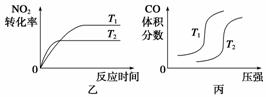
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
4CO(g)+2NO2(g)  4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com