
解析:本题考查了分析讨论及计算推理的能力。解本题的关键是先弄清16.8 g残留固体是什么物质。存在两种情况:一种全部是铜;另一种是铜和剩余的铁的混合物。
由题意n(![]() )=n(Ba2+)=4 mol·L-1×0.4 L=1.6 mol
)=n(Ba2+)=4 mol·L-1×0.4 L=1.6 mol
若原溶液中溶质全部是CuSO4: Fe+CuSO4====FeSO4+Cu,反应的Fe为1.6 mol×56 g· mol-1=89.6 g。
若原溶液中溶质全部是Fe2(SO4)3:Fe+Fe2(SO4)3====3FeSO4,反应的Fe为1.6/3 mol×56 g· mol-1=29.9 g。
因而若要使CuSO4、Fe2(SO4)3全部反应所需Fe的质量应在29.9 g—89.6 g之间,现加入的铁粉质量为21.7 g,所以铁粉的量不足,故16.8 g固体应全部是Cu。
因为氧化性Fe3+>Cu2+,故Fe先与Fe2(SO4)3反应,设Fe2(SO4)3物质的量为x,CuSO4物质的量为y。
Fe+Fe2(SO4)3====3FeSO4
x x
Fe+CuSO4====Cu+FeSO4
![]() mol
mol ![]() mol
mol
依题意得:
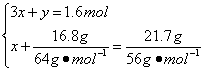
解得![]()
![]()
![]()
答案:c(CuSO4)=2.45 mol·L-1
c〔Fe2(SO4)3〕=0.25 mol·L-1


科目:高中化学 来源: 题型:阅读理解
实验室用铜制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
(1)为了节约原料,硫酸和硝酸的物质的量之比最佳为: ;为了吸收该反应中产生的尾气,请选择下列中合适的装置 。
(2)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质甲调节pH ,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全),然后过滤、浓缩、结晶。
已知:Ksp[Cu((OH)2]≈10-22, Ksp[Fe((OH)2]≈10-16, Ksp[Fe((OH)3]≈10-38
请回答下列问题:
如开始加入的铜粉为3.2 g,最后所得溶液为500 mL,溶液中含有铁元素0.005 mol。
①方案1中的B仪器名称是 。
②为了使铁元素全部沉淀,应调节pH至少为_________。
③方案2中甲物质可选用的是 。
A、 CaO B、NaOH C、CuCO3 D、Cu2(OH)2CO3 E、Fe2(SO4)3
④反应中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因 。
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol·L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O10.5g。
请回答下列问题:
⑤反应时温度控制在50℃~60℃不宜过高的原因是 ,
⑥本实验CuSO4·5H2O的产率为 。
查看答案和解析>>
科目:高中化学 来源:2012届山东省聊城市五校高三上学期期末联考化学试卷 题型:单选题
用铂作电极电解500 mL含KNO3和Cu(NO3)2的混合溶液一段时间后,在两极均生成11.2L标准状况下的气体,原溶液中Cu2+的物质的量浓度为( )
| A.0.5 mol/L | B.2 mol/L | C.l mol/L | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省南山中学高二下学期期中考试化学试卷(带解析) 题型:单选题
在500 mL KNO3和Cu(NO3)2的混合溶液中c(NO- 3)="6" mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中 c(K+)为2 mol?L-1 | B.上述电解过程中转移电子总数为2 NA |
| C.电解得到的Cu的物质的量为0.5 mol | D.电解后溶液中c(H+)为2 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省济南市高三3月模拟考试理综化学试卷(解析版) 题型:实验题
某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下:

(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6 mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有? ?? ? 、?? ??? 。
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是??? (填下列各项中序号)。

②CuCl2溶液中存在如下平衡:Cu(H2O)42+(蓝色)+4Cl- CuCl42-(黄色)+4H2O。
CuCl42-(黄色)+4H2O。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是?? ??? (填下列各项中序号)。
a.FeCl3固体 ????? b.CuCl2固体 ???? c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO2生成曲线如下图所示。

①CuS矿样在焙烧过程中,有Cu2S、CuO·CuSO4、CuSO4、CuO生成,转化顺序为:

第①步转化主要在200~300oC范围内进行,该步转化的化学方程式为??????????????????????????????????????????????????????????????? 。
②300~400oC范围内,固体质量明显增加的原因是? ??????? ? ,上图所示过程中,CuSO4固体能稳定存在的阶段是??? (填下列各项中序号)。
a.一阶段??? b、二阶段??? c、三阶段? d、四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。

a.装置组装完成后,应立即进行的一项操作是? ???????????? 。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物。你认为装置D中原来盛有的溶液为? ??? ? 溶液。
c.若原CuS矿样的质量为l0.0 g,在实验过程中,保持温度在760oC左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.0 g,则原矿样中CuS的质量分数为?? ?? 。
查看答案和解析>>
科目:高中化学 来源:2014届四川省高二下学期期中考试化学试卷(解析版) 题型:选择题
在500 mL KNO3和Cu(NO3)2的混合溶液中c(NO- 3)="6" mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中 c(K+)为2 mol?L-1 B.上述电解过程中转移电子总数为2 NA
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com