
 2SO3已经达到平衡状态的标志是
2SO3已经达到平衡状态的标志是| A.容器中SO2、O2和SO3共存 |
| B.SO2和SO3的物质的量浓度相等 |
| C.反应器内压强不再变化 |
| D.容器中的SO2、O2、SO3的物质的量之比为2:1:2 |
 2SO3为可逆反应,无论反应是否达到平衡状态,三种物质都存在,所以容器中三种物质共存时不是达到平衡状态的标志,故A错误;SO2和SO3的物质的量浓度相等只是过程的一个特殊时刻,即这并不意味着反应达到平衡,故B错误;该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的浓度不变,导致容器中压强不随时间的变化而改变,故C正确;SO2、O2与SO3的物质的量之比为2:1:2,这与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故D错误。
2SO3为可逆反应,无论反应是否达到平衡状态,三种物质都存在,所以容器中三种物质共存时不是达到平衡状态的标志,故A错误;SO2和SO3的物质的量浓度相等只是过程的一个特殊时刻,即这并不意味着反应达到平衡,故B错误;该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的浓度不变,导致容器中压强不随时间的变化而改变,故C正确;SO2、O2与SO3的物质的量之比为2:1:2,这与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故D错误。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:单选题
 cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是
cZ(g)的影响,将X和Y以物质的量之比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是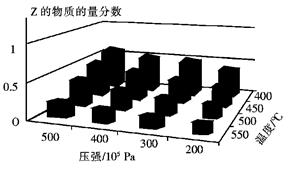
| A.△H<0,a+b>c |
| B.△H>0,a+b<c |
| C.△H>0,a+b>c |
| D.△H<0,a+b<c |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
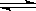 2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42- + 2H+,把K2Cr2O7溶于水配成稀溶液是橙色。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g)+qD(g)。若增大压强或升高温度,重新达到平衡,随时间变化过程均如图所示,则对该反应的叙述中正确的是( )
pC(g)+qD(g)。若增大压强或升高温度,重新达到平衡,随时间变化过程均如图所示,则对该反应的叙述中正确的是( )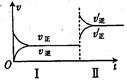
| A.正反应是放热反应,m+n<p+q |
| B.逆反应是放热反应,m+n>p+q |
| C.正反应是放热反应,m+n>p+q |
| D.逆反应是放热反应,m+n<p+q |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 H2S(g) K1,
H2S(g) K1, SO2(g) K2。则相同温度下反应H2(g)+SO2(g)
SO2(g) K2。则相同温度下反应H2(g)+SO2(g)  O2(g)+H2S(g)的
O2(g)+H2S(g)的| A.K1+K2 | B.K1-K2 | C.K1·K2 | D.K1/K2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
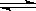 cC(g)的平衡体系中,无论升高温度或降低压强,C的浓度都会增大,则以下说法正确的是
cC(g)的平衡体系中,无论升高温度或降低压强,C的浓度都会增大,则以下说法正确的是 | A.a+b<c正反应吸热 | B.a+b>c正反应吸热 |
| C.a+b>c正反应放热 | D.a+b<c正反应放热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
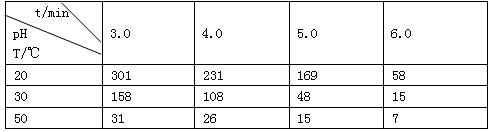
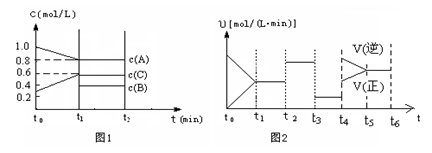
| 时间段 | t1~t2 | t2~t3 | t3~t4 | t5~t6 |
| 平衡常数 | K1 | K2 | K3 | K4 |
 CH3OH(g)反应合成甲醇。
CH3OH(g)反应合成甲醇。| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
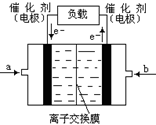
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g),下列判断正确的是
2SO3(g),下列判断正确的是| A.2 mol SO2和足量O2反应,必定生成2 mol SO3 |
| B.该反应在容积不变的密闭容器中,若混合气的密度不变,说明达到平衡状态 |
| C.平衡时,SO2消耗速率必定等于O2生成速率的两倍 |
| D.平衡时,SO2浓度必定等于O2浓度的两倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com