
【题目】短周期元素X、Y、Z、W在周期表中的位置关系如图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
X | Y | Z | |
W |
(1)X元素在元素周期表中的位置_____________________.
(2)X 、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为____________.
(3)超细WY粉末被应用于大规模集成电路领域.其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1;其反应的化学方程式为______.
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器______![]() 填“能”或“不能”
填“能”或“不能”![]() 用来腌制咸菜,原因是______.
用来腌制咸菜,原因是______.
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇![]() 氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式______
氧化钠,其中Z2-可以在固体介质NASICON中自由移动.则负极的反应式______![]() 关于该电池的下列说法,正确的是______
关于该电池的下列说法,正确的是______
A 工作时电极b作正极,Z2-通过固体介质NASICON由电极b流向电极a
B 工作时电流由电极a通过传感器流向电极b
C 传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:____________![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]()

【答案】第二周第ⅣA族 ![]()
![]()
![]()
![]() 不能 氯离子会破坏铝表面氧化膜
不能 氯离子会破坏铝表面氧化膜 ![]() AC
AC ![]() 2 16 5 2 8
2 16 5 2 8
【解析】
由短周期元素X、Y、Z、W在周期表中的位置可知,X、Y、Z处于第二周期,W处于第三周期,在同周期元素的常见简单离子中,W的简单离子半径最小,则W为Al,可推知X为C、Y为N、Z为O.
(1)主族元素周期数=电子层数、主族族序数=最外层电子数;
(2)液态NH3与液态H2O可以发生类似方式电离,则液态NH3中电离得到NH4+、NH2-;
(3)Al2O3、N2、C在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1,反应生成AlN与CO;
(4)氯离子会破坏铝表面氧化膜;
(5)该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为![]() ,正极上氧气得电子发生还原反应,原电池放电时电子从负极流向正极,阴离子向负极移动,一氧化碳的含量越大,原电池放电时产生的电流越大;
,正极上氧气得电子发生还原反应,原电池放电时电子从负极流向正极,阴离子向负极移动,一氧化碳的含量越大,原电池放电时产生的电流越大;
(6)由元素C与元素O组成的某种阴离子具有还原性,能被酸性KMnO4氧化,该阴离子为C2O42-,利用化合价升降相等及原子守恒、电荷守恒进行配平。
由短周期元素X、Y、Z、W在周期表中的位置可知,X、Y、Z处于第二周期,W处于第三周期,在同周期元素的常见简单离子中,W的简单离子半径最小,则W为Al,可推知X为C、Y为N、Z为O.
(1)X为C元素,原子核外有2个电子层、最外层电子数为4,处于周期表中第二周第ⅣA族;
(2)液态NH3与液态H2O可以发生类似方式电离,则液态NH3中电离得到NH4+、NH2-,NH2-中N原子与H原子之间形成1对共用电子对,其电子式为:![]() ;
;
(3)Al2O3、N2、C在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:1,反应生成AlN与CO,反应方程式为: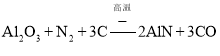 ,
,
(4)氯离子会破坏铝表面氧化膜,铝容器不能用来腌制咸菜;
(5)该装置是原电池,负极上一氧化碳失电子发生氧化反应,电极反应式为![]() ,
,
A.工作时电极b通入空气,b作正极,阴离子向负极移动,O2-由电极b流向电极a, A项正确;
B.原电池放电时电子从负极流向正极,故电流由电极b通过传感器流向电极a,B项错误;
C.一氧化碳的含量越大,原电池放电时产生的电流越大,C项正确;
答案选AC;
(6)由元素C与元素O组成的某种阴离子具有还原性,能被酸性KMnO4氧化,该阴离子为C2O42-,反应中C元素化合价由+3升高为+4,Mn元素化合价由+7降低为+2,化合价升降最小公倍数为10,C2O42-的系数为5,MnO4的系数为2,由原子守恒可知:CO2的系数为10,![]() 的系数为5,H2O为8,H+的系数为16,故配平后离子方程式为:
的系数为5,H2O为8,H+的系数为16,故配平后离子方程式为:![]() ;
;


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度是97,分子中C、H原子个数相同,且C、H原子个数之和是氧原子数的5倍。已知:各有机物间存在如下转化关系:
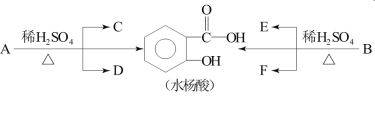
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)A的分子式是________。
(2)E中所含官能团的名称是________;完全燃烧时,1 mol D与1 mol下列________的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(3)写出水杨酸与小苏打反应的化学方程式是___________;写出C与F反应的化学方程式是_________。
(4)同时符合下列要求的同分异构体有___________种。
①与A互为同分异构体;
②能发生水解反应;
③苯环上有两个取代基,且苯环上的一氯代物只有1种。
(5)1 mol 上述(4)中的一种有机物X,能与4 mol NaOH发生反应,写出此反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11.9g金属锡(Sn)跟100mL12mol·L-1 HNO3共热一段时间。完全反应后测定溶液中c(H+)为8 mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是( )
A.SnO2·4H2OB.Sn(NO3)4
C.Sn(NO3)2D.Sn(NO3)2和Sn(NO3)4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是

A. b膜是阳离子交换膜
B. A极室产生气泡并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. B极室产生的气体可使湿润的KI淀粉试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节.某研究性学习小组设计了将粗MnO2含有较多的MnO和MnCO3样品转化为纯MnO2实验,其流程如图:
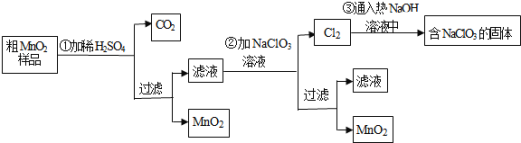
![]() 第
第![]() 步加稀H2SO4时,粗MnO2样品中的MnO和______
步加稀H2SO4时,粗MnO2样品中的MnO和______![]() 写化学式
写化学式![]() 转化为可溶性物质.
转化为可溶性物质.
![]() 完成第
完成第![]() 步反应的离子方程式:
步反应的离子方程式:
______ ______+_____ClO3-+ _____Mn2+=______MnO2+______Cl2↑+______ ______
![]() 过滤操作必需的玻璃仪器有______、______、______,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有______
过滤操作必需的玻璃仪器有______、______、______,已知蒸发得到的固体中有NaClO3和NaOH,则一定还有含有______![]() 写名称
写名称![]() .
.
![]() 若粗MnO2样品的质量为25.38g,第
若粗MnO2样品的质量为25.38g,第![]() 步反应后,经过滤得到17.4g MnO2,并收集到0.448LCO2(标准状况下),则在第
步反应后,经过滤得到17.4g MnO2,并收集到0.448LCO2(标准状况下),则在第![]() 步反应中至少需要______mol NaClO3 .
步反应中至少需要______mol NaClO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.12.4 g白磷(P4)中所含的P-P键数目为0.6 NA
B.40 g SiC晶体中含有SiC分子的数目为NA个
C.1 mol麦芽糖完全水解后产生的葡萄糖分子数目为NA
D.标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:

(1)表中的实线表示元素周期表的左右边界,请用实线补全元素周期表的上下边界。________
(2)表中最活泼的金属与最活泼的非金属形成的物质是________(填化学式)。
(3)由a、d两种元素可形成两种化合物,写出其中一种化合物分解生成另一种化合物的化学方程式:_______,这两种化合物中所含的化学键有______(填字母)。
A.极性共价键 B.非极性共价键 C.离子键
(4) e、f、k、m对应的单原子离子的半径由大到小的顺序为____________(填离子符号)。
(5) d、m对应的离子还原性由强到弱顺序为__________(填离子符号)。
(6) d、e、m的气态氢化物中,最不稳定的是__________(填分子式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。

已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是
,下列叙述正确的是
A. 曲线m表示pH与lg![]() 的变化关系
的变化关系
B. 当溶液呈中性时,c(Na+)=![]() +2
+2![]()
C. Ka1(H2CO3)=1.0×10-6.4
D. 25℃时,CO32-+H2O![]()
![]() +OH-的平衡常数为1.0×10-7.6
+OH-的平衡常数为1.0×10-7.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com