
| A. | SO42- | B. | SO32- | C. | S | D. | S2- |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. |  蒸馏水 | B. | 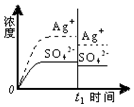 0.010mol•L-1 Ag2SO4溶液 | ||
| C. | 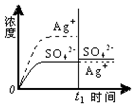 0.020mol•L-1 Na2SO4溶液 | D. | 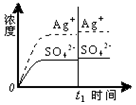 0.040mol•L-1 AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的燃烧热为297KJ/mol | |
| B. | 1mol硫蒸气完全燃烧放出的热量大于297KJ | |
| C. | 1mol硫蒸气完全燃烧放出的热量小于297KJ | |
| D. | 形成1mol SO2化学键所释放总能量大于断裂1molS(s)和1molO2 (g)的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S H2 CO2 | B. | SO2 Cl2 H2S | ||
| C. | O2 SO2 Cl2 | D. | HCl Cl2 SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由被氧化的元素组成的反应物是氧化剂 | |
| B. | 在一个氧化还原反应中,氧化反应和还原反应同时发生 | |
| C. | 由化合态转变为游离态的变化一定是还原反应 | |
| D. | 氧化还原反应的实质是元素化合价的升降 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
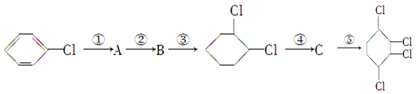
 ,B:
,B: ,C:
,C: .
. +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O.
+NaCl+H2O.查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上10月月考化学试卷(解析版) 题型:选择题
在密闭容器中有可逆反应:nA(g)+mB(g) pC(g)处于平衡状态(已知 n+m>p,正反应为吸热反应),则下列说法正确的是( )
pC(g)处于平衡状态(已知 n+m>p,正反应为吸热反应),则下列说法正确的是( )
升温,c(B)/c(C)的比值变小
降温时体系内混合气体平均分子量变小
加入 B,A 的转化率减小
加入催化剂,气体总的物质的量不变
加压使容器体积减小,A 或 B 的浓度一定增大
⑥ 若 A 的反应速率为 v A ,则 B 的反应速率 v B =(n/m)v
A、①②④⑤ B、①②③⑤ C、①②③⑥ D、③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com