
铜锌原电池装置(见图),下列分析正确的是
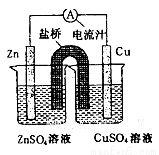
A.一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小
B.原电池工作时,Cu电极流出电子,发生氧化反应
C.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu
D.盐桥中装有含氯化钾的琼脂,其作用是传递电子
科目:高中化学 来源:2013-2014学年广东省十校联考高三下学期理综化学试卷(解析版) 题型:选择题
下列实验“操作和现象”与“结论”对应关系正确的是
| 操作和现象 | 结论 |
A | 常温下将Al片放入浓硝酸中,无明显变化 | Al与浓硝酸不反应 |
B | 向0.1mol·L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热, 红色加深。 | 说明盐类水解是吸热反应 |
C | 向FeCl3溶液加入足量的铜粉,充分反应,静置,取上层清液 滴加几滴KSCN溶液,溶液不变血红色。 | 说明氧化性:Fe3+>Cu2+ |
D | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省德州市高三4月模拟考试(二模)理综化学试卷(解析版) 题型:选择题
化学与社会、生产、生活密切相关。下列说法正确的是
A.碳纤维是一种新开发的材料,它属于合成有机高分子化合物
B.对“地沟油”进行分馏可得到汽油
C.漂白粉长期暴露在空气中最后会变质失效
D.氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是:( )
A.常温常压下,22.4 L乙烯中C—H键数为4 NA
B.1 mol羟基中电子数为10NA
C.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA
D.常温下,1 L 0.1 mol/L NH4NO3溶液中NH4+的数目小于6.02×1022
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:填空题
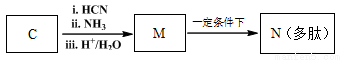
高分子化合物G是作为锂电池中Li+迁移的介质,合成G的流程如下:
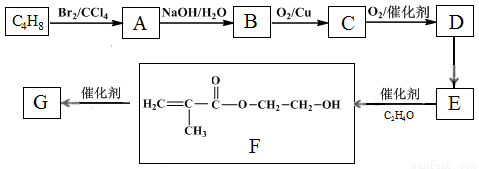
已知:①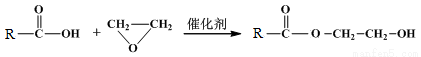
②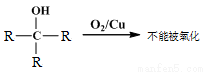
(1)B的含氧官能团名称是 。
(2)A→B的反应类型是 。
(3)C的结构简式是 。
(4)D→E反应方程式是 。
(5)G的结构简式是 。
(6)D的一种同分异构体,能发生分子内酯化反应生成五元环状化合物,该同分异构体的结构简式是 。
(7)已知: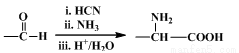
M→N的化学方程式是 。
(8)下列说法正确的是 (填字母)。
a.E有顺反异构体
b.C能发生加成、消去反应
c.M既能与酸反应,又能与碱反应
d.苯酚与 C反应能形成高分子化合物
e.含有-OH和-COOH的D的同分异构体有2种
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:填空题
下表中列出五种短周期元素A、B、C、D、E的信息,请推断后回答:
元素 | 有 关 信 息 |
A | 元素主要化合价为-2,原子半径为0.074 nm |
B | 所在主族序数与所在周期序数之差为4 |
C | 原子半径为0.102 nm,其单质为黄色晶体,可在A的单质中燃烧 |
D | 最高价氧化物的水化物能按1︰1电离出电子数相等的阴、阳离子 |
E | 原子半径为0.075 nm,最高价氧化物的水化物可与其氢化物形成一种盐X |
(1)写出C元素在周期表中的位置 ,写出D元素最高价氧化物的水化物电子式 ;
(2)写出B单质与水反应的离子方程式 ;
(3)元素A和D形成的某种化合物可作为呼吸面具中氧气的来源,写出得到氧气反应的主要化学方程式 ;
(4)X的水溶液显 (填“酸”、“碱”或“中”)性,用离子方程式解释其原因是 ;
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y与空气组成的燃料电池中,电解质溶液是30%的KOH溶液,该电池放电时正极的电极反应式为 ;
(6)若使用Y—空气燃料电池精炼铜,当得到精铜80 g时,燃料电池中转移的电子数为 NA。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市通州区高三年级模拟考试(一)理综化学试卷(解析版) 题型:选择题
下列装置或操作不能实现实验目的的是
|
|
|
|
A.吸收易溶于水的气体 | B. 实验室制取氨气 | C.配制银氨溶液 | D.实验室制乙烯 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:选择题
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A.4 s时c(B)为0.76 mol/L
B.830℃达平衡时,A的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为0.4
A(g)+B(g)的平衡常数的值为0.4
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:填空题
铁及其化合物在生产、生活中存在广泛用途,完成下列填空。
(1)如图所示为铁元素在周期表中的信息,方格中“55.85”的意义为: 。铁原子核外有 种运动状态不同的电子。

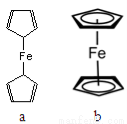
(2)二茂铁[Fe(C5H5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂。二茂铁属于 晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为图中的 (选填“a”或“b”)。
(3)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,
写出发生变质反应的离子方程式 。
(4)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是 。
(5)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4 + 6Na2O2 → 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,若生成2mol Na2FeO4,则反应中电子转移的物质的量为 mol。
(6)高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含 Mn2+ 1mg的水体样本,需要1.2 mg/L高铁酸钾 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com