
”¾ĢāÄæ”æA”¢B”¢C”¢DŹĒ֊ѧ»Æѧ֊³£¼ūµÄµ„ÖŹ£¬DĪŖµŲæĒÖŠŗ¬Įæ×ī¶ąµÄ½šŹō£»¼×”¢ŅŅ”¢±ūĪŖ»ÆŗĻĪļ£¬ĘäÖŠ¼×ĪŖÓŠ“ÅŠŌµÄŗŚÉ«¾§Ģ壬ŅŅŌŚ³£ĪĀ³£Ń¹ĻĀĪŖĪŽÉ«ŅŗĢ壮ø÷ĪļÖŹµÄ×Ŗ»Æ¹ŲĻµČēĻĀ£ŗ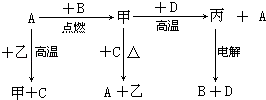
£Ø1£©×é³ÉDµÄŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ £®
£Ø2£©ČōÓĆŅ»ÖÖ·“Ó¦ĄąŠĶøÅĄØÉĻŹö×Ŗ»ÆÖŠĖłÉę¼°µ½µÄČ«²æ·“Ó¦£¬øĆ·“Ó¦ĄąŠĶŹĒ £®
£Ø3£©ŌŚÉĻŹöµē½ā·“Ó¦ÖŠ£¬Ńō¼«µÄ¼«·“Ó¦Ź½ŹĒ £®
£Ø4£©¼×ŗĶD·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ £®
£Ø5£©DµÄijÖÖŃĪ³£ÓĆÓŚ¾»Ė®£¬ÓĆĄė×Ó·½³ĢŹ½±ķŹ¾Ęä¾»Ė®ŌĄķ £®
”¾“š°ø”æ
£Ø1£©µŚČżÖÜĘŚµŚ¢óA×å
£Ø2£©Ńõ»Æ»¹Ō·“Ó¦
£Ø3£©2O2©©4e©=O2”ü
£Ø4£©3Fe3O4+8Al ![]() 9Fe+4Al2O3
9Fe+4Al2O3
£Ø5£©Al3++3H2O?Al£ØOH£©3+3H+
”¾½āĪö”æ½ā£ŗDĪŖµŲæĒÖŠŗ¬Įæ×ī¶ąµÄ½šŹō£¬Ó¦ĪŖAl£¬¼×ĪŖÓŠ“ÅŠŌµÄŗŚÉ«¾§Ģ壬ӦĪŖFe3O4 £¬ ŅŅŌŚ³£ĪĀ³£Ń¹ĻĀĪŖĪŽÉ«ŅŗĢ壬ӦĪŖH2O£¬ÓÉ×Ŗ»Æ¹ŲĻµ¼×+D”ś±ū+AæÉÖŖ£¬±ūĪŖAl2O3 £¬ AĪŖFe£¬µē½ā±ūæɵƵ½ŃõĘųŗĶĀĮ£¬ŌņBĪŖO2 £¬ ĢśŗĶĖ®ÕōĘūŌŚøßĪĀĻĀ·“Ӧɜ³ÉFe3O4ŗĶH2 £¬ ŌņCĪŖH2 £¬ £Ø1£©ÓÉŅŌÉĻ·ÖĪöæÉÖŖDĪŖAl£¬Ī»ÓŚÖÜĘŚ±ķµŚČżÖÜĘŚµŚ¢óA×壬ĖłŅŌ“š°øŹĒ£ŗµŚČżÖÜĘŚµŚ¢óA×壻£Ø2£©ĢāÖŠ·“Ó¦¶¼Óɵ„ÖŹ²Ī¼Ó£¬Ņ»¶ØĪŖŃõ»Æ»¹Ō·“Ó¦£¬ĖłŅŌ“š°øŹĒ£ŗŃõ»Æ»¹Ō·“Ó¦£»£Ø3£©µē½āŃõ»ÆĀĮ£¬Ńō¼«·¢ÉśŃõ»Æ·“Ӧɜ³ÉŃõĘų£¬Ņõ¼«·¢Éś»¹Ō·“Ӧɜ³ÉĀĮ£¬Ńō¼«µē¼«·½³ĢŹ½ĪŖ2O2©©4e©=O2”ü£¬ĖłŅŌ“š°øŹĒ£ŗ2O2©©4e©=O2”ü£»£Ø4£©¼×ŗĶD·“Ó¦ĪŖĀĮČČ·“Ó¦£¬·½³ĢŹ½ĪŖ3Fe3O4+8Al ![]() 9Fe+4Al2O3 £¬ ĖłŅŌ“š°øŹĒ£ŗ3Fe3O4+8Al
9Fe+4Al2O3 £¬ ĖłŅŌ“š°øŹĒ£ŗ3Fe3O4+8Al ![]() 9Fe+4Al2O3£»£Ø5£©Ć÷·Æ³£ÓĆÓŚ¾»Ė®£¬Ö÷ŅŖŹĒĄūÓĆĮĖĀĮĄė×ÓĖ®½āæÉÉś³É¾ßÓŠĪüø½ŠŌµÄĒāŃõ»ÆĀĮ½ŗĢ壬Ąė×Ó·½³ĢŹ½ĪŖAl3++3H2OAl£ØOH£©3+3H+ £¬ ĖłŅŌ“š°øŹĒ£ŗAl3++3H2OAl£ØOH£©3+3H+ £®
9Fe+4Al2O3£»£Ø5£©Ć÷·Æ³£ÓĆÓŚ¾»Ė®£¬Ö÷ŅŖŹĒĄūÓĆĮĖĀĮĄė×ÓĖ®½āæÉÉś³É¾ßÓŠĪüø½ŠŌµÄĒāŃõ»ÆĀĮ½ŗĢ壬Ąė×Ó·½³ĢŹ½ĪŖAl3++3H2OAl£ØOH£©3+3H+ £¬ ĖłŅŌ“š°øŹĒ£ŗAl3++3H2OAl£ØOH£©3+3H+ £®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖĶāµēĀ·ÖŠ£¬µē×ÓÓÉĶĮ÷Ļņa¼«£®ĻĀĶ¼ĖłŹ¾µÄ×°ÖĆ·ÖĪöŗĻĄķµÄŹĒ£Ø £© 
A.øĆ×°ÖĆÖŠCu¼«ĪŖÕż¼«
B.µ±Ķ¼«µÄÖŹĮæ±ä»ÆĪŖ25.6gŹ±£¬a¼«ÉĻĻūŗĵÄO2ŌŚ±ź×¼×“æöĻĀµÄĢå»żĪŖ4.48L
C.b¼«·“Ó¦µÄµē¼«·“Ó¦Ź½ĪŖ£ŗH2©2e©=2H+
D.Ņ»¶ĪŹ±¼äŗóŠæʬ֏Įæ¼õÉŁ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠŹ¾ŅāĶ¼ÖŠ£¬°×Ēņ“ś±ķĒāŌ×Ó£¬ŗŚĒņ“ś±ķŗ¤Ō×Ó£¬·½æņ“ś±ķČŻĘ÷£¬ČŻĘ÷ÖŠ¼äÓŠŅ»øöæÉŅŌÉĻĻĀ»¬¶ÆµÄøō°å£ØĘäÖŹĮæŗöĀŌ²»¼Ę£©£®ĘäÖŠÄܱķŹ¾µČÖŹĮæµÄĒāĘųÓėŗ¤ĘųµÄŹĒ£Ø £©
A.
B.
C.
D.
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·“Ó¦ÖŠ£¬Ė®×÷Ńõ»Æ¼ĮµÄŹĒ( )
A. ·śĘųĶØČėĖ®ÖŠB. ĀČĘųĶØČėĖ®ÖŠ
C. ¶žŃõ»ÆµŖČÜÓŚĖ®D. ÄĘÓėĖ®·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æij»ÆѧŠ”×éÄ£Äā¹¤ŅµÉś²śÖĘČ”HNO3Éč¼ĘĻĀĶ¼ĖłŹ¾×°ÖĆ£¬ĘäÖŠaĪŖŅ»øöæɳ֊ų¹ÄČėæÕĘųµÄĻšĘ¤Ēņ”£

£Ø1£©Š“³ö×°ÖĆAÖŠÖ÷ŅŖ·“Ó¦µÄ»Æѧ·½³ĢŹ½________________________________£»
£Ø2£©Š“³ö×°ÖĆBÖŠÖ÷ŅŖ·“Ó¦µÄ»Æѧ·½³ĢŹ½_______________________________________£»
£Ø3£©×°ÖĆCÖŠÅØH2SO4µÄ×÷ÓĆŹĒ_______________________________£»
£Ø4£©ĒėÄć°ļÖśøĆ»ÆѧŠ”×éÉč¼ĘŹµŃéŹŅÖĘČ”NH3µÄĮķŅ»·½°ø_______________________________£¬²¢Š“³öNH3µÄĮ½ÖÖÓĆĶ¾:____________________________________________”£
£Ø5£©øÉŌļ¹ÜÖŠµÄ¼īŹÆ»ŅÓĆÓŚøÉŌļNH3£¬Ä³Ķ¬Ń§Ė¼æ¼ŹĒ·ńæÉÓĆĪŽĖ®Ńõ»ÆøĘ“śĢę¼īŹÆ»Ņ£¬²¢Éč¼ĘĻĀĶ¼ĖłŹ¾×°ÖĆ(ŅĒĘ÷¹Ģ¶Ø×°ÖĆŹ”ĀŌĪ“»)½ųŠŠŃéÖ¤”£ŹµŃé²½ÖčČēĻĀ:

¢ŁÓĆÉÕĘæŹÕ¼ÆĀśøÉŌļµÄ°±Ęų£¬Į¢¼“ČūÉĻČēĶ¼ĖłŹ¾µÄĻš½ŗČū”£
¢ŚÕżĮ¢ÉÕĘ棬Ź¹ĪŽĖ®ĀČ»ÆøĘ¹ĢĢ廬ČėÉÕĘæµ×²æ£¬Ņ”¶Æ£¬æÉŅŌ¹Ū²ģµ½µÄĻÖĻóŹĒ_________________£¬ÓÉ“Ė£¬øĆĶ¬Ń§µĆ³ö½įĀŪ:²»ÄÜÓĆĪŽĖ®ĀČ»ÆøĘ“śĢę¼īŹÆ»Ņ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄÜŌ“ĪŹĢāČÕŅę³ÉĪŖÖĘŌ¼¹ś¼ŹÉē»į¾¼Ć·¢Õ¹µÄĘæ¾±£®¼×“¼ŹĒŅ»ÖÖæÉŌŁÉśÄÜŌ“£¬¾ßÓŠ¹ć·ŗµÄæŖ·¢ŗĶÓ¦ÓĆĒ°¾°£¬Ņņ“Ė¼×“¼±»³ĘĪŖ21ŹĄ¼ĶµÄŠĀŠĶČ¼ĮĻ£®
¹¤ŅµÉĻÓĆCOÉś²śČ¼ĮĻ¼×“¼£¬Ņ»¶ØĢõ¼žĻĀ·¢Éś·“Ó¦£ŗCO£Øg£©+2H2£Øg£©CH3OH£Øg£©£®Ķ¼1±ķŹ¾·“Ó¦ÖŠÄÜĮæµÄ±ä»Æ£»Ķ¼2±ķŹ¾Ņ»¶ØĪĀ¶ČĻĀ£¬ŌŚĢå»żĪŖ2LµÄĆܱÕČŻĘ÷ÖŠ¼ÓČė4mol H2ŗĶŅ»¶ØĮæµÄCOŗó£¬COŗĶCH3OH£Øg£©µÄÅضČĖꏱ¼ä±ä»ÆĶ¼£®
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ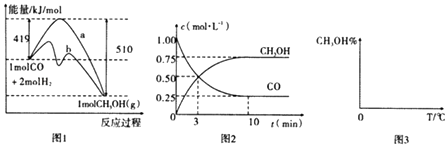
£Ø1£©ŌŚ”°Ķ¼1”±ÖŠ£¬ĒśĻߣØĢī”°a”±»ņ”°b”±£©±ķŹ¾Ź¹ÓĆĮĖ“߻ƼĮ£»øĆ·“Ó¦ŹōÓŚ£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©·“Ó¦£®
£Ø2£©øł¾Ż”°Ķ¼2”±ÅŠ¶Ļ£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ £®
A.ĘšŹ¼³äČėµÄCOĪŖ1mol
B.Ōö¼ÓCOÅØ¶Č£¬COµÄ×Ŗ»ÆĀŹŌö“ó
C.ČŻĘ÷ÖŠŃ¹Ēæŗć¶ØŹ±£¬·“Ó¦ŅŃ“ļĘ½ŗāדĢ¬
D.±£³ÖĪĀ¶ČŗĶĆܱÕČŻĘ÷ČŻ»ż²»±ä£¬ŌŁ³äČė1mol COŗĶ2mol H2 £¬ ŌŁ“Ī“ļµ½Ę½ŗāŹ± ![]() »įŌö“ó
»įŌö“ó
£Ø3£©“Ó·“Ó¦æŖŹ¼µ½½ØĮ¢Ę½ŗā£¬v£ØH2£©=£»øĆĪĀ¶ČĻĀCO£Øg£©+2H2£Øg£©CH3OH£Øg£©µÄ»ÆŃ§Ę½ŗā³£ŹżĪŖ £® Čō±£³ÖĘäĖūĢõ¼ž²»±ä£¬ĻņĘ½ŗāĢåĻµÖŠŌŁ³äČė0.5mol CO”¢1molH2”¢1.5molCH3OH£¬“Ė·“Ó¦½ųŠŠµÄ·½ĻņĪŖ£ØĢī”°Õż·“Ó¦·½Ļņ”±»ņ”°Äę·“Ó¦·½Ļņ£©”±£®
£Ø4£©ĒėŌŚ”°Ķ¼3”±ÖŠ»³öĘ½ŗāŹ±¼×“¼ÕōĘų°Ł·Öŗ¬Įæ£Øׯ×ų±ź£©ĖęĪĀ¶Č£Øŗį×ų±ź£©±ä»ÆµÄĒśĻߣ¬ŅŖĒó»Ń¹Ēæ²»Ķ¬µÄ2ĢõĒśĻߣØŌŚĒśĻßÉĻ±ź³öp1”¢p2 £¬ ĒŅp1£¾p2£©£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A. Ħ¶ūŹĒ¹ś¼Źµ„Ī»ÖĘÖŠµÄ7 øö»ł±¾ĪļĄķĮæÖ®Ņ»
B. Ź§Č„µē×Ó¶ąµÄ»¹Ō¼Į£¬»¹ŌŠŌŅ»¶ØĒæ
C. øł¾ŻŹĒ·ńÓŠ¶”“ļ¶ūŠ§Ó¦½«·ÖÉ¢Ļµ·ÖĪŖČÜŅŗ”¢½ŗĢåŗĶ×ĒŅŗ
D. ”°AŃõ»ÆB”±Óė”°B±»AŃõ»Æ”±£¬”°A±»B»¹Ō”±±ķ“ļµÄŗ¬ŅåĻąĶ¬
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĪĀ¶ČĻĀ½«2mol AŗĶ2mol BĮ½ÖÖĘųĢå»ģŗĻÓŚ2LĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśČēĻĀ·“Ó¦£ŗ3A£Øg£©+B£Øg£©2C£Øg£©+2D£Øg£©£¬2·ÖÖÓÄ©·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬Éś³ÉĮĖ0.8mol D£¬ĒėĢīŠ“ĻĀĆęæÕ°×£ŗ
£Ø1£©ÓĆB±ķŹ¾µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ £¬ AµÄ×Ŗ»ÆĀŹĪŖ £®
£Ø2£©Čē¹ūĖõŠ”ČŻĘ÷ČŻ»ż£ØĪĀ¶Č²»±ä£©£¬ŌņĘ½ŗāĢåĻµÖŠ»ģŗĻĘųĢåµÄĆÜ¶Č £¬ »ģŗĻĘųĢåĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ£ØĢī”°Ōö“ó”±”¢”°¼õÉŁ”±»ņ”°²»±ä”±£©£®
£Ø3£©ČōæŖŹ¼Ź±Ö»¼ÓCŗĶDø÷ ![]() mol£¬ŅŖŹ¹Ę½ŗāŹ±ø÷ĪļÖŹµÄĪļÖŹµÄĮæŌĘ½ŗāĻąµČ£¬Ōņ»¹Ó¦¼ÓČėmol BĪļÖŹ£®
mol£¬ŅŖŹ¹Ę½ŗāŹ±ø÷ĪļÖŹµÄĪļÖŹµÄĮæŌĘ½ŗāĻąµČ£¬Ōņ»¹Ó¦¼ÓČėmol BĪļÖŹ£®
£Ø4£©ČōĻņŌĘ½ŗāĢåĻµŌŁĶ¶Čė1mol AŗĶ1mol B£¬Ę½ŗā£ØĢī”°ÓŅŅĘ”¢×óŅĘ»ņ²»ŅĘ”±£©£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĪĀ¶ČĻĀ£¬Ļņ2LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1.0mol AŗĶ1.0mol B£¬·“Ó¦A£Øg£©+B£Øg£©C£Øg£©¾¹żŅ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā£®·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
t/s | 0 | 5 | 15 | 25 | 35 |
n£ØA£©/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.·“Ó¦ŌŚĒ°5sµÄĘ½¾łĖŁĀŹv£ØA£©=0.17molL©1s©1
B.±£³ÖĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬Ę½ŗāŹ±c£ØA£©=0.41molL©1 £¬ Ōņ·“Ó¦µÄ”÷H£¾0
C.ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė2.0mol C£¬“ļµ½Ę½ŗāŹ±£¬CµÄ×Ŗ»ÆĀŹ“óÓŚ80%
D.ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė0.20mol A£¬0.20mol BŗĶ1.0mol C£¬·“Ó¦“ļµ½Ę½ŗāĒ°v£ØÕż£©£¼v£ØÄę£©
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com