
| A.1mol/L氢氰酸溶液的pH约为3 |
| B.HCN易溶于水 |
| C.10mL 1mol/L HCN恰好与10mL 1mol/L NaOH溶液完全反应 |
| D.HCN溶液的导电性比HCl溶液的弱 |
 互动英语系列答案
互动英语系列答案科目:高中化学 来源:不详 题型:单选题
| A.通入少量HCl气体 | B.加入少量NaOH固体 | C.加入少量H2O | D.升高温度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 NH3·H2O
NH3·H2O NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格: | | 条件的变化 | 通氨气 | 加水 | 加NH4Cl(s) |
| ① | 电离平衡移动的方向 | | | |
| ② | c(OH-)的变化 | | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中| A.加少量烧碱溶液 | B.降低温度 | C.加少量冰醋酸 | D.加水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
A.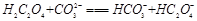 |
B.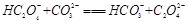 |
C.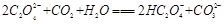 |
D.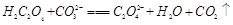 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H++SO42-.
H++SO42-.| A.c(SO42-)+c(HSO4-)=0.1 mol·L-1 | B.c(SO42-)+c(HSO4-)=2 c(Na+) |
| C.c(OH-)=c(H+)+c(HSO4-) | D.c(Na+)+c(H+)=c(OH-)+c(HSO4-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.配制0.10 mol/L CH3COOH溶液,测溶液的pH,若pH大于1,则可证明醋酸为弱电解质 |
| B.用pH计分别测0.01 mol/L和0.10 mol/L的醋酸溶液的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质 |
| C.对盐酸和醋酸溶液进行导电性实验,若与CH3COOH溶液相串联的灯泡较暗,证明醋酸为弱电解质 |
| D.配制0.10 mol/L CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原氨水的浓度=10-3mol /L |
| B.氨水的电离程度增大,溶液中所有离子的浓度均减小 |
C.溶液中 的增大 的增大 |
| D.再加入10mLpH=3的盐酸,混合液pH=7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com