

 ,B为
,B为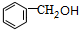 ,G为
,G为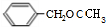 ,据此解答.
,据此解答. ,B为
,B为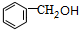 ,G为
,G为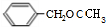 ,
, ,分子式为C7H7Cl,故答案为:C7H7Cl;
,分子式为C7H7Cl,故答案为:C7H7Cl;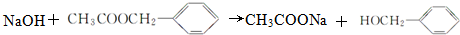 ,
,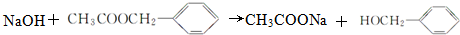 ;
;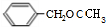 的同分异构体:能够与新制的银氨溶液反应产生光亮的银镜,含有-CHO,苯环上有3个取代基,且有两个取代基相同,还含有2个-CH3,2个-CH3相邻,-CHO有2种位置,2个-CH3处于间位,-CHO有3种位置,2个-CH3处于对位,-CHO有1种位置,故符合条件的同分异构体有2+3+1=6种,其中氢原子共有四种不同环境的所有物质的结构简式为:
的同分异构体:能够与新制的银氨溶液反应产生光亮的银镜,含有-CHO,苯环上有3个取代基,且有两个取代基相同,还含有2个-CH3,2个-CH3相邻,-CHO有2种位置,2个-CH3处于间位,-CHO有3种位置,2个-CH3处于对位,-CHO有1种位置,故符合条件的同分异构体有2+3+1=6种,其中氢原子共有四种不同环境的所有物质的结构简式为: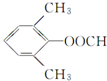 、
、 ,
, 、
、 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.6 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、埃博拉病毒无法通过呼吸传播 |
| B、佩戴口罩可有效预防埃博拉病毒侵染 |
| C、目前已找到有效治疗埃博拉病毒的方法 |
| D、埃博拉病毒颗粒直径大约80nm |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2SO4的电离方程式为:H2SO4=H2++SO4-2 |
| B、铁粉溶于盐酸的化学方程式:2Fe+6HCl=2FeCl3+3H2↑ |
C、氯离子的结构示意图: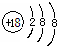 |
| D、乙醇的分子式为C2H6O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,上下层液体均从下口放出 |
| B、蒸馏时忘记放碎瓷片可停止加热,冷却后补加 |
| C、蒸发结晶时,应将蒸发皿中的溶液全部蒸干 |
| D、过滤时,为加快过滤速度可搅拌漏斗内的液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com