
| A. | 常温下,NO分解产生O2的反应平衡常数表达式为K1=[N2][O2] | |
| B. | 常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 | |
| C. | 常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 | |
| D. | 以上说法都不正确 |
分析 A.化学平衡常数是指生成物的浓度幂之积除以反应物的浓度幂之积的数值;
B.根据方程式的书写反写,平衡常数是原来的倒数;
C.根据化学平衡常数K的数值越大,化学反应进行的程度越大;
D.根据ABC选项的情况回答.
解答 解:A.常温下,NO分解产生O2的反应的平衡常数表达式式K1=$\frac{c(N{\;}_{2})•c(O{\;}_{2})}{c{\;}^{2}(NO)}$,故A错误;
B.2H2(g)+O2(g)?2H2O(g) K2=2×1081,所以2H2O(g)?2H2(g)+O2(g) K=$\frac{1}{2×10{\;}^{81}}$=5×10-82,故B错误;
C.由2H2O(g)?2H2(g)+O2(g) K=5×10-82,则常温下,NO、H2O、CO2三种化合物分解放出O2的化学平衡常数K的数值逐渐减少,则化学反应进行倾向由大到小的顺序为NO>H2O>CO2,故C正确;
D.因C正确,故D错误;
故选:C.
点评 本题考查的是化学平衡常数的相关知识,化学平衡常数是指生成物的浓度幂之积除以反应物的浓度幂之积的数值.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
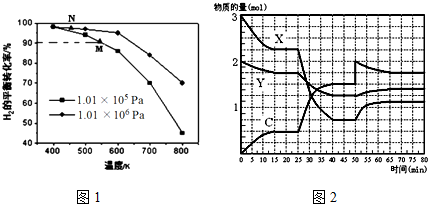
| 压强/MPa C% 速度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
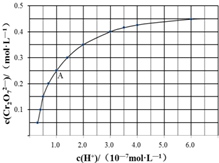 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
 ,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com