
【题目】实验室用镁和硝基苯制取反式偶氮苯(溶解性:不溶于水,溶于醇、醚)。实验原理如下:
2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→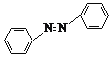 +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
(1)反应中,硝基苯变为反式偶氮苯的反应属于_______________
A、取代反应 B、消去反应 C、还原反应 D、氧化反应
(2)在反应装置中,加入原料及溶剂,搅拌下加热回流。反应加入的镁条应用砂纸打磨干净的原因是_____________________________________。
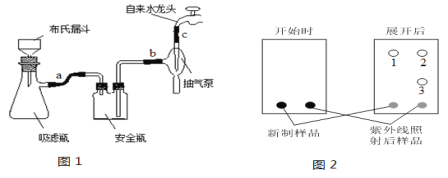
(3)反应结束后将反应液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗产品析出,抽滤(抽滤装置如图1),滤渣用95%乙醇水溶液重结晶提纯。
①为了得到较大颗粒的晶体,加入乙酸时需要____________(填“缓慢加入”、“快速加入”)。
②抽滤过程中要洗涤粗产品,下列液体最合适的是___________。
A.乙醚 B.蒸馏水 C.95%乙醇水溶液 D.饱和NaCl溶液
③重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的___________操作除去了不溶性杂质,____________操作除去了可溶性杂质。
【答案】 C 镁易被氧化,其表面有氧化物,打磨是为了除去表面的氧化物 缓慢加入 B 趁热过滤 抽滤
【解析】(1)去氧或加氢为还原反应;(2)镁易被氧化,故镁条表面有氧化物,需用砂纸打磨干净;(3)①结晶速度越慢可得到较大颗粒的晶体;②洗涤时应该注意不能引入新的杂质;③趁热过滤可以除去不溶性杂质。
(1)根据反应2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→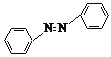 +4Mg(OCH3)2+4H2O的原理,硝基苯变为反式偶氮苯为去氧反应,反应属于还原反应;答案选C;(2)反应加入的镁条应用砂纸打磨干净的原因是除去镁条表面的氧化物;(3)①结晶速度越慢可得到较大颗粒的晶体,故应缓慢加入乙酸;②抽滤过程中要洗涤粗产品,注意不能引入新的杂质,选择用蒸馏水冲洗的液体是最好的,答案选B;③重结晶过程:加热溶解→趁热过滤→冷却结晶→抽滤→洗涤→干燥,其中趁热过滤可以除去不溶性杂质,冷却结晶,抽滤可以除去可溶性杂质。
+4Mg(OCH3)2+4H2O的原理,硝基苯变为反式偶氮苯为去氧反应,反应属于还原反应;答案选C;(2)反应加入的镁条应用砂纸打磨干净的原因是除去镁条表面的氧化物;(3)①结晶速度越慢可得到较大颗粒的晶体,故应缓慢加入乙酸;②抽滤过程中要洗涤粗产品,注意不能引入新的杂质,选择用蒸馏水冲洗的液体是最好的,答案选B;③重结晶过程:加热溶解→趁热过滤→冷却结晶→抽滤→洗涤→干燥,其中趁热过滤可以除去不溶性杂质,冷却结晶,抽滤可以除去可溶性杂质。


科目:高中化学 来源: 题型:
【题目】向一定量的NaOH溶液中逐滴加入AlCl3溶液,生成沉淀Al(OH)3的量随AlCl3加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
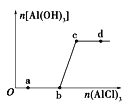
A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:K+、Ag+、Ca2+、NO3-
D. d点对应的溶液中:K+、NH4+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置(加热装置已略去)或操作合理的是( )
|
|
|
|
A.吸收氨气并防倒吸 | B.用SO2与Ba(NO3)2反应获得BaSO3沉淀 | C.分离溴苯和苯的混合物 | D. 验证HCl的溶解性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置可制取 H2,两个电极均为惰性电极,c 为阴离子交换膜。下列叙述正确的是

A. a 为电源的正极
B. 工作时,OH向左室迁移
C. 右室电极反应为:C2H5OH+H2O4e=CH3COO+5H+
D. 生成 H2 和 CH3COONa 的物质的量之比为 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+3B(g)![]() 2C(g)+D(g)中,下列表示反应速率最快的是
2C(g)+D(g)中,下列表示反应速率最快的是
A. v(A)=0.5 mol/(L·min)B. v(B)=0.6 mol/(L·min)
C. v(C)=0.4 mol/(L·min)D. v(D)=0.3 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀厂曾采用有氰电镀工艺,处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,在酸性条件下CNO-继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并通过测定二氧化碳的量确定CN-被处理的百分率。
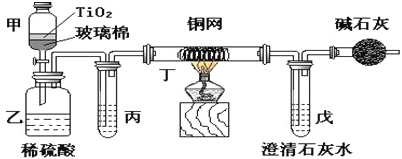
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.05 molL-1倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)甲中反应的离子方程式为________________________,乙中反应的离子方程式为________________________。
(2)乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等。丙中加入的除杂试剂是饱和食盐水,其作用是_____________________,丁在实验中的作用是______________,装有碱石灰的干燥管的作用是______________________________。
(3)戊中盛有含Ca(OH)20.02mol的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于__________。该测得值与工业实际处理的百分率相比总是偏低,简要说明可能原因之一_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图表示反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
2SO3(g) △H<0的正反应速率随时间的变化情况,试根据此曲线判断下列说法可能正确的是
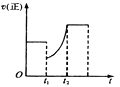
A. t1时增加了SO2和O2的浓度,平衡向正反应方向移动
B. t1时降低了温度,平衡向正反应方向移动
C. t1时减小了压强,平衡向逆反应方向移动
D. t1时减小了SO2的浓度,又增加了SO3的浓度,导致平衡向逆反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com