
【题目】我国是世界上最早制得和使用金属锌的国家,一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示,下列有关说法不正确的是( )
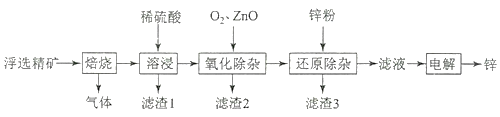
A.滤渣1的成分是SiO2 , 滤渣2的成分是Fe(OH)3
B.焙烧过程中主要反应的化学方程式为2ZnS+3O2![]() 2ZnO+2SO2
2ZnO+2SO2
C.溶液中的Cd2+可用锌粉除去,反应的离子方程式为Zn+Cd2+=Zn2++Cd
D.若不通入氧气,其后果是无法除去杂质Fe2+
【答案】A
【解析】
闪锌矿主要含有ZnS,还含有SiO2和少量FeS、CdS、PbS杂质,焙烧过程中发生的反应有2ZnS+3O2![]() 2ZnO+2SO2、4FeS+7O2
2ZnO+2SO2、4FeS+7O2![]() 2Fe2O3+4SO2、2PbS+3O2
2Fe2O3+4SO2、2PbS+3O2![]() 2PbO+2SO2、2CdS+3O2
2PbO+2SO2、2CdS+3O2![]() 2CdO+2SO2,所以焙烧过程中生成的气体是SO2;然后加入稀硫酸酸浸,FeS(未焙烧)、ZnO、Fe2O3、PbO、CdO和稀硫酸反应生成Fe2+、Zn2+、Fe3+、PbSO4、Cd2+,所以滤渣1为未反应的SiO2和生成的PbSO4;氧化除杂时,通入氧气,使Fe2+转化为Fe3+,加入ZnO调节溶液的pH值,将Fe3+转化为Fe(OH)3而除去Fe3+,滤渣2为生成的Fe(OH)3;然后向溶液中加入Zn,Zn和Cd2+发生氧化还原生成Cd,然后过滤得到滤液,滤渣3为Cd;将滤液电解得到Zn。
2CdO+2SO2,所以焙烧过程中生成的气体是SO2;然后加入稀硫酸酸浸,FeS(未焙烧)、ZnO、Fe2O3、PbO、CdO和稀硫酸反应生成Fe2+、Zn2+、Fe3+、PbSO4、Cd2+,所以滤渣1为未反应的SiO2和生成的PbSO4;氧化除杂时,通入氧气,使Fe2+转化为Fe3+,加入ZnO调节溶液的pH值,将Fe3+转化为Fe(OH)3而除去Fe3+,滤渣2为生成的Fe(OH)3;然后向溶液中加入Zn,Zn和Cd2+发生氧化还原生成Cd,然后过滤得到滤液,滤渣3为Cd;将滤液电解得到Zn。
A. 加入稀硫酸酸浸,FeS(未焙烧)、ZnO、Fe2O3、PbO、CdO和稀硫酸反应生成Fe2+、Zn2+、Fe3+、PbSO4、Cd2+,所以滤渣1为未反应的SiO2和生成的PbSO4;氧化除杂时,通入氧气,使Fe2+转化为Fe3+,加入ZnO调节溶液的pH值,将Fe3+转化为Fe(OH)3而除去Fe3+,滤渣2为生成的Fe(OH)3,A错误;
B. 闪锌矿主要含有ZnS,还含有SiO2和少量FeS、CdS、PbS杂质,焙烧过程中发生的主要反应有2ZnS+3O2![]() 2ZnO+2SO2,B正确;
2ZnO+2SO2,B正确;
C. Zn的金属性强于Cd,可以从溶液中将Cd置换出来,其离子反应方程式为:Zn+Cd2+=Zn2++Cd,C正确;
D. 氧化除杂时,通入氧气,使Fe2+转化为Fe3+,加入ZnO调节溶液的pH值,将Fe3+转化为Fe(OH)3而除去Fe3+,若不通入氧气,无法除去杂质Fe2+,D正确;
故答案为:A。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.MgO(s)+C(s)=CO(g)+Mg(g)高温下能自发进行,则该反应ΔH>0、ΔS>0
B.常温下等物质的量浓度的CH3COOH溶液和HCl溶液中,水的电离程度相同
C.0.1 mol·L-1 NH4Cl溶液加水稀释,![]() 的值增大
的值增大
D.对于反应2SO2+O22SO3,使用催化剂能加快反应速率并提高SO2的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO等)制备草酸镍晶体的流程如下:
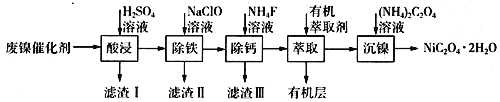
(1)请写出一种能提高“酸浸”速率的措施:________________________;滤渣I的成分是____________(填化学式)。
(2)除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:
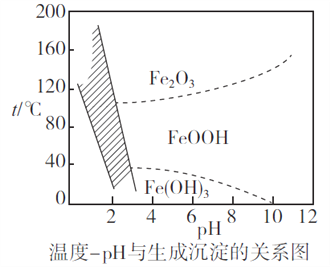
①若控制温度40℃、pH=8,则滤渣II的主要成分为_________________________(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:___________________________________________。
(3)已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,则所加c(NH4F)=_________mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有机萃取剂的作用是________________________。
(5)某化学镀镍试剂的化学式为MxNi(SO4)y(M为+1价阳离子,Ni为+2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要________________________。
②该镀镍试剂的化学式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原电池的知识,下列反应可设计成原电池的是( )
A.CH3CH2OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
B.Ba(OH)28H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
C.H2SO4+2NaOH=Na2SO4+2H2O
D.CaO+H2O=Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.铅蓄电池放电时,负极质量减轻,正极增重
B.升高CH3COONa溶液的温度,其水的离子积常数和pH均增大
C.CH3CH=CHCH3分子中的四个碳原子都在一条直线上
D.常温下Ksp(AgBr)=5.0×10-13,Ksp(AgCl)=1.8×10-10,则S(AgBr)>S(AgCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用相同浓度的NaOH溶液,分别滴定20mL0.1mol·L-1的三种酸(HA、HB和HD)溶液体积的变化曲线如图所示。下列判断正确的是( )
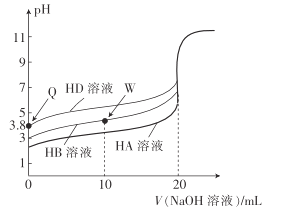
A.由Q点可知,HD的电离平衡常数Ka≈10-7.6
B.三种酸的酸性强弱:HD>HB>HA
C.滴定至W点时,溶液中存在:c(B-)>c(Na+)>c(H+)>c(OH-)
D.当三种溶液恰好完全中和后将其混合,溶液中存在:c(Na+)=c(A-)+c(B-)+c(D-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.100 mL 1 mol·L-1 NaClO溶液中ClO-的数目为0.1NA
B.46 g 75%的C2H5OH溶液中所含O原子数目为0.75NA
C.7.6 g过氧乙酸(CH3COOOH)所含过氧键数目为0.1NA
D.标准状况下,22.4 L 氯气与水充分反应转移电子数目NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喹啉(![]() )是治疗新冠肺炎的药物氯喹的基础原料,其合成路线如下:
)是治疗新冠肺炎的药物氯喹的基础原料,其合成路线如下:
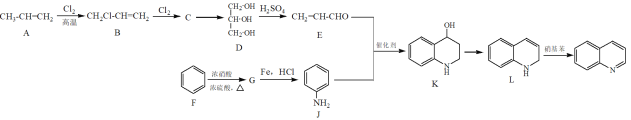
下列有关说法正确的是
A.C→D的反应条件为NaOH水溶液,加热
B.可以用溴水来检验化合物E中的碳碳双键
C.F→G和G→J的反应类型分别为取代反应和还原反应
D.与喹啉互为同分异构体,且含有碳碳双键和氰基(-CN)的芳香族化合物共有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A 分子式为C8H8O2。A 的核磁共振氢谱有 4 个峰且面积之比为 1∶2∶2∶3,A 分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图所示。关于A的下列说法中,正确的是
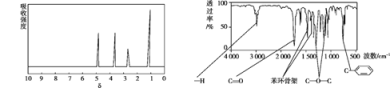
A.符合题中A 分子结构特征的有机物只有 1 种
B.1 mol A 在一定条件下可与 4 mol H2 发生加成反应
C.A 在一定条件下能发生银镜反应
D.与A 属于同类化合物的同分异构体只有 2 种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com