
【题目】下列关于合金说法的是
A. 合金为化合物 B. 合金具有金属特性
C. 合金耐腐蚀 D. 合金的硬度一定比成分金属的低
科目:高中化学 来源: 题型:
【题目】(1)人体内的铁元素以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。这句话说明维生素C在这一反应中起的作用是__________________。
(2)实验室可以用铜和稀硝酸反应制取NO,反应的化学方程式如下:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑ +4H2O
①该反应中还原剂为__________
②氧化剂与还原剂之比是__________
③如果反应中转移了0.15mol电子,则产生的气体在标准状况下体积为______________
④用双线桥标出该反应转移电子数目情况_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中,中间有一个可自由滑动的隔板,将容器分成两部分。当左边充入1molN2,右边充入8gCO和CO2的混合气体时,隔板处于如下图所示位置,V甲:V乙=4:1(两侧温度、压强均相同)。则混合气体中CO和CO2的物质的量比为( )

A. 1:1 B. 1:3 C. 3:1 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑+ H2O
B. CaO+H2O=Ca(OH)2
C. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
D. CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氢化法制备高铁酸钠,生产过程如下:
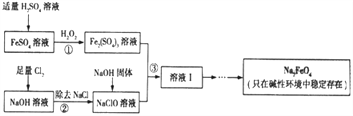
(1)高铁酸钠中铁元素的化合价为____________,次氯酸钠的电子式是__________________。
(2)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是__________________。
(3)步骤①反应的离子方程式是_________________________________。
(4)Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_________。(计算结果保留两位小数)
工业废水中常含有一定量的Cr2O![]() 易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O
易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O![]() 转化为Cr3+,再将Cr3+转化为沉淀。
转化为Cr3+,再将Cr3+转化为沉淀。
(5)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理_____________________________________________。
(6)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为_________。
(7)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。写出Cr(OH)3的酸式电离方程式______________。
(8)Cr3+在强碱溶液中可被双氧水氧化为CrO![]() ,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO
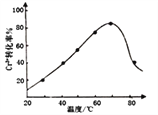
,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO![]() +8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
+8H2O。控制其他条件不变,反应温度对Cr3+转化率的影响如图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列各题:
Ⅰ.下列实验不能成功的是______________
A.为了检验R-X是碘代烷,将R-X与NaOH水溶液共热,经充分反应后冷却,向冷却液中加稀HNO3酸化后,再加AgNO3溶液,观察沉淀颜色
B.为检验淀粉是否水解,将淀粉与少量稀H2SO4共热一段时间,加入新制的Cu(OH)2 ,观察变化
C. 向银氨溶液中加入几滴乙醛后用酒精灯加热至沸制取银镜
D.无水乙醇与浓硫酸按1:3的体积比混合快速加热到170℃左右制取乙烯
Ⅱ.有机物M的结构简式为: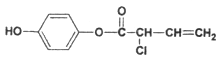 ,则:
,则:
(1)1 mol M最多消耗的H2、Br2、NaOH溶液的比值为_________________;
写出M在酸性(稀硫酸)条件下的水解反应方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸正丁酯是医药合成的重要中间体,某同学在实验室中用乙酸和正丁醇来制取,实验操作如下:
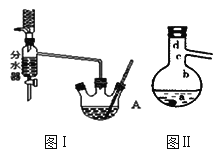
Ⅰ.将混合液(18.5 mL正丁醇和13.4 mL过量乙酸,0.4 mL浓硫酸)置于仪器A中并放入适量沸石(见图I,沸石及加热装置等略去),然后加热回流约20分钟。
Ⅱ.将反应后的溶液进行如下处理:①用水洗涤,②用试剂X干燥,③用10% Na2CO3溶液洗涤。
Ⅲ.将所得到的乙酸正丁酯粗品转入蒸馏烧瓶中进行蒸馏,最后得到17.1 g乙酸正丁酯。
部分实验数据如下表所示:
化合物 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 溶解度(g)/(100 g水) |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
乙酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
(1)使用分水器(实验中可分离出水)能提高酯的产率,其原因是_______________.
(2)步骤Ⅱ中的操作顺序为____________(填序号),试剂X不能选用下列物质中的______________(填字母序号)。
a.无水硫酸镁 b.新制生石灰 c.无水硫酸钠
(3)步骤Ⅲ(部分装置如图Ⅱ所示)。
①当仪器连接好后,a.向相应的冷凝管中通冷凝水;b.加热蒸馏烧瓶,先后顺序是___________。(填“先a后b”或“先b后a”)
②温度计水银球所处的位置不同,会影响馏出物的组成,当温度计水银球分别位于图Ⅱ中的________(填“a”“b”“c”或“d”)点时会导致收集到的产品中混有较多的低沸点杂质。
(4)该实验乙酸正丁酯的产率是_____________。(计算结果保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )
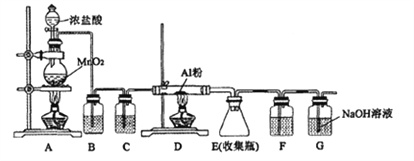
A. B装置中所装试剂为饱和的NaCl溶液,其作用是除去氯气中的HCl
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知MnO2为黑色难溶于水的固体,实验室制取氧气的反应为2KClO3![]() 2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
2KCl+3O2↑,反应后从剩余固体中回收二氧化锰的操作顺序正确的是( )
A. 溶解、过滤、蒸发、洗涤 B. 溶解、过滤、洗涤、加热
C. 溶解、蒸发、洗涤、过滤 D. 溶解、洗涤、过滤、加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com