
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)I的最高化合价为___,I的元素名称为___。
(2)写出基态时K元素原子的电子排布式___,J元素原子的外围电子排布式___。
(3)下列对比正确的是___。
a.原子半径H>G>B>A
b.第一电离能E>D>C>B
c.电负性A>H>G>Q
d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是___。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
【答案】+6 铬 1s22s22p63s23p63d104s1 3d64s2 cd bc
【解析】
由元素在周期表中位置,可知P为H、A为C、B为N、C为O、D为F、E为Ne、F为Mg、G为Al、H为Si、I为Cr、J为Fe、K为Cu、Q为Ga、L为Rb、N为At。
(1)I为Cr元素,名称为铬,原子序数为24,价电子排布式为3d54s1,最高正化合价为+6,故答案为:+6;铬;
(2)K为Cu,原子核外有29个电子,核外电子排布式为1s22s22p63s23p63d104s1;J为Fe,原子核外有26个电子,核外电子排布式为1s22s22p63s23p63d64s2,则外围电子排布式为3d64s2,故答案为:1s22s22p63s23p63d104s1;3d64s2;
(3)a.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径G>H>A>B,故a错误;
b.同周期自左而右第一电离能呈增大趋势,但IIA族、VA元素的第一电离能高于同周期相邻元素的,故第一电离能E>D>B>C,故b错误;
c.同周期自左而右电负性增大、同主族自上而下电负性减小,故电负性A>H>G>Q,故c正确;
d.非金属性B>A>H>G,则最高价氧化物的水化物酸性B>A>H>G,故d正确;
故答案为:cd;
(4)a.由L的位置可知,L位于元素周期表中第五周期ⅠA族,属于s区元素,故a正确;
b.由O的位置可知,O位于元素周期表中第七周期Ⅷ族,属于d区元素,故b错误;
c.M位于IB族,外围电子排布式为5d106s1,属于ds区元素,故c错误;
d.H处于IVA族,所在族的外围电子排布式为ns2np2,属于p区元素,故d正确;
故答案为:bc。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)已知铁的相对原子质量是56 ,则1个铁原子的质量是_______g。(用NA表示)
(2)在标准状况下,1.7g氨气所占的体积为_______L,它与标准状况下_____L硫化氢含有相同数目的氢原子。
(3)已知CO、CO2的混合气体质量共16.0g,标准状况下体积为8.96L,则可推知该取混合气体中含CO____g,所含CO2在标袱状况下的体积为__________L。
(4)同温同压下同体积的H2和A气体的质量分别是0.2g和l.6g,则气体A的摩小质量为________,含有A的分子个数为________。(用NA表示)
(5)标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是_____mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (a)、
(a)、![]() (b)、
(b)、![]() (c)的分子式均为C5H6,下列有关叙述正确的是( )
(c)的分子式均为C5H6,下列有关叙述正确的是( )
A.符合分子式C5H6的有机物只有a、b、c三种
B.a、b、c的一氯代物都只有三种
C.a、b、c都能使溴的CCl4溶液褪色,且褪色原理相同
D.a、b、c分子中的5个碳原子一定都处于同一个平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成。如图1装置是用燃烧法确定有机物分子式常用的装置。
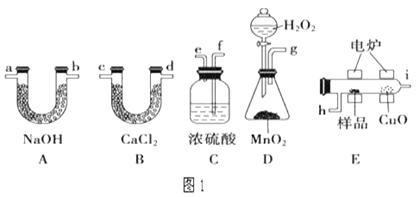
(1)燃烧管中CuO的作用是_____。
(2)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取1.48g样品,经充分反应后,A管质量增加3.52g,B管质量增加1.8g,则该样品的实验式为_____。
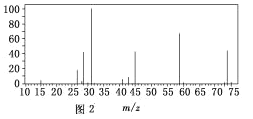
(3)用质谱仪测定其相对分子质量,得如图2所示的质谱图,则该有机物的相对分子质量为_____。
(4)若只根据A的实验式能否确定其分子式____(填“能”或“不能”)。
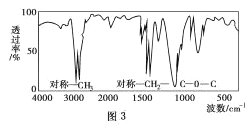
(5)该物质的红外光谱图如图3所示,则其结构简式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理__________,哪些违反了洪特规则__________。

(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为__________;其最高价氧化物对应水化物的化学式是__________。
(3)将下列多电子原子的原子轨道按轨道能量由低到高顺序排列。
①2s ②3d ③4s ④3s ⑤4p ⑥3p
轨道能量由低到高排列顺序是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.环戊二烯(![]() )分子中所有原子共平面
)分子中所有原子共平面
B.同主族元素含氧酸的酸性随核电荷数的增加而减弱
C.二甲醚易溶于水,氨基乙酸的熔点较高,主要原因都与氢键有关
D.1-二环丙基乙烯(![]() )的二氯代物共有(不含立体异构)9种
)的二氯代物共有(不含立体异构)9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白桦脂酸对白血病等恶性肿瘤细胞有抑制作用,其结构简式如图所示,在白桦脂酸中加入合适的试剂检验其官能团(必要时可加热),下列试剂、现象、结论都正确的一项是

选项 | 试剂 | 现象 | 结论 |
A | 氯化铁溶液 | 溶液变色 | 含有羟基 |
B | 银氨溶液 | 有银镜产生 | 含有醛基 |
C | 碳酸氢钠溶液 | 有气泡产生 | 含有羧基 |
D | 酸性KMnO4溶液 | 溶液褪色 | 含有碳碳双键 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南京理工大学团队成功合成了能在温室稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,经 X 射线衍射测得晶体结构,其局部结构如图所示(其中N5-的立体结构是平面五元环)。下列说法正确的是( )

A.所有N 原子的价电子层结构均有孤对电子
B.氮氮键的键能:N5->H2N-NH2
C.两种阳离子是等电子体
D.阴阳离子之间只存在离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知p(M)=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是

A.向BaSO4悬浊液中加入浓度较大的Pb(NO3)2溶液可能转化成PbSO4
B.X、Y两点对应的SrSO4均是饱和溶液,不能继续溶解SrSO4
C.蒸发Z点的BaSO4溶液可得到C点状态的BaSO4溶液
D.溶度积:Ksp(SrSO4)<Ksp(PbSO4)<Ksp(BaSO4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com