
| ① | A是形成化合物种类最多的元素之一 |
| ② | B元素原子核外各能级所排电子数相同 |
| ③ | D是地壳中含量最多的元素 |
| ④ | E在常温下能与水剧烈反应产生A单质 |
| ⑤ | F是日常生活中最常用的金属之一 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

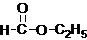
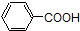
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子序数和原子半径大小顺序均为:X<Y<Z |
| B、元素X与元素Y能形成离子化合物 |
| C、元素Z最高价氧化物对应水化物具有两性 |
| D、元素Y形成的气态氢化物水溶液呈强酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol O2与金属钠反应,O2不一定得到4NA个电子 |
| B、标准状况下,a L CH4和a L C6H14中所含分子数均为a NA/22.4 |
| C、常温常压下,1mol氯气与足量的金属镁反应,转移2NA个电子 |
| D、在20℃、1.01×105 Pa时,2.8g C2H4和CO的混合气体含气体分子数等于0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电子沿Zn→a→b→Cu路径流动 |
| B、Cu电极上发生氧化反应 |
| C、甲池与乙池中的溶液互换,闭合K仍有电流产生 |
| D、片刻后可观察到滤纸a点变红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 6.0 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焓变是一个与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应 |
| B、增大压强是通过提高活化分子的百分数来提高反应速率 |
| C、氮的固定只有在高温、高压、催化剂的条件下才能实现 |
| D、水煤气是可再生能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com