
【题目】钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上可利用多种钼矿制备钼酸钠。镍钼矿(主要含有MoS2、NiS2、NiS、FeS2、SiO2和C)是我国特有的一种多金属复杂硫化矿资源,常用来进行钾、镍等战略有色金属的提取。工业上进行选择性还原熔炼可以提取镍铁合金同时得到钼酸钠晶体(Na2MoO4·2H2O),其主要流程如图:
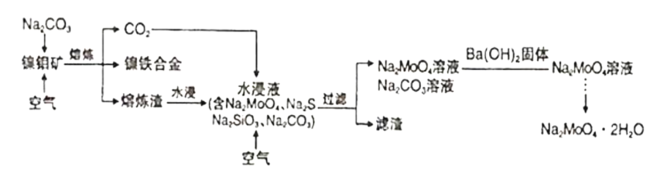
已知:Na2MoO4·2H2O是白色晶体,在水中的溶解度随温度升高而增大。
(1)还原熔炼过程中发生了较多的化学变化请结合题干信息补充完整NiS发生的化学反应方程式,并配平。___
□NiS+□Na2CO3+3C+2O2![]() ___+____+___。
___+____+___。
(2)向水浸液中通人适量CO2和空气,然后过滤,所得滤渣的主要成分为___。
(3)已知过滤所得混合液中c(MoO42-)=0.40mol·L-1,c(CO32-)=0.10mol·L-1,加入Ba(OH)2固体除去CO32-。当BaMoO4开始沉淀时,CO32-的去除率是___。
(已知Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4×10-8)
(4)从钼酸钠溶液中获取钼酸钠晶体的操作___。
(5)工业上还可以利用如图所示电解装置浸取辉钼矿(主要成分为MoS2)得到Na2MoO4和Na2SO4溶液,制备钼酸钠晶体。
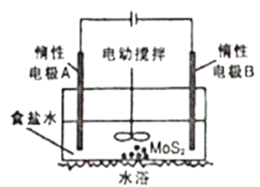
①电解一段时间,电极B附近pH___(填“增大”“减小”或“不变”);
②简述MoO42-生成的原因___。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在二种不同介质中的腐蚀速率实验结果如图所示:
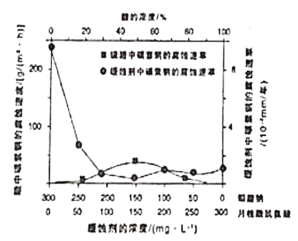
①已知:钼酸钠、月挂酰肌氨酸的相对分子质量分别为M1、M2,要使碳素钢的缓蚀效果最优,钼酸钠和月挂酰肌氨酸的物质的量浓度比应为____;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是____。
【答案】NiS+Na2CO3+3C+2O2![]() 2Ni+2Na2S+5CO2 S、H2SiO3 90% 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 增大 阳极产生Cl2使MoS2氧化为Na2MoO4 M2:M1 常温下铁遇浓硫酸钝化
2Ni+2Na2S+5CO2 S、H2SiO3 90% 蒸发浓缩、冷却结晶、过滤、洗涤、干燥 增大 阳极产生Cl2使MoS2氧化为Na2MoO4 M2:M1 常温下铁遇浓硫酸钝化
【解析】
镍钼矿主要含有MoS2、NiS2、NiS、FeS2、SiO2和C,灼烧镍钼矿,MoS2燃烧,反应方程式为:2MoS2+7O2![]() 2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,然后向溶液中加入沉淀剂除去重金属离子,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4.2H2O。
2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,然后向溶液中加入沉淀剂除去重金属离子,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4.2H2O。
(1)根据氧化还原反应,得失电子守恒,C元素的化合价从0价升高为+4价生成二氧化碳,Ni元素的化合价从+2价降低为0价,生成单质Ni,O元素的化合价从0价降低为-2价生成二氧化碳,反应方程式为:NiS+Na2CO3+3C+2O2![]() 2Ni+2Na2S+5CO2,故答案为:NiS+Na2CO3+3C+2O2
2Ni+2Na2S+5CO2,故答案为:NiS+Na2CO3+3C+2O2![]() 2Ni+2Na2S+5CO2;
2Ni+2Na2S+5CO2;
(2)SiO2是酸性氧化物,能与碱性溶液反应,水浸液中含SiO32-,通入二氧化碳后发生反应为SiO32-+CO2+H2O=H2SiO3↓+CO32-;水浸液中还含S2-,通入空气被氧化生成S单质,所得到的沉淀为H2SiO3,S,故答案为:H2SiO3,S;
(3)Ksp(BaMoO4)=4×10-8,钼酸钠溶液中c(MoO42-)=0.40 molL-1,BaMoO4开始沉淀时,溶液中钡离子的浓度为:c(Ba2+)=![]() =1×10-7mol·L-1,Ksp(BaCO3)=1×10-9,溶液中碳酸根离子浓度为:c(CO32-)=
=1×10-7mol·L-1,Ksp(BaCO3)=1×10-9,溶液中碳酸根离子浓度为:c(CO32-)=![]() =1.0×10-2 mol·L-1,原溶液中c(CO32-)=0.10molL-1,碳酸根离子的去除率为:(1-
=1.0×10-2 mol·L-1,原溶液中c(CO32-)=0.10molL-1,碳酸根离子的去除率为:(1-![]() )×100%=1-10%≈90%,故答案为:90%;
)×100%=1-10%≈90%,故答案为:90%;
(4)钼酸钠溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,即可得到钼酸钠晶体,故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)①根据图可知,电极B为阴极,发生还原反应,水电离出的氢离子放电,所以电解一段时间后,B附近pH增大,故答案为:增大;
②电极A为阳极,发生氧化反应,溶液中的氯离子失去电子生成氯气,氯气与水反应生成次氯酸,次氯酸将MoS2氧化生成MoO42-,故答案为:阳极产生Cl2使MoS2氧化为Na2MoO4;
(6)①根据图示可知,当钼酸钠、月桂酸肌氨酸浓度相等时,腐蚀速率最小,腐蚀效果最好, ,当
,当![]() 相同时,c与M成反比,即物质的量浓度比为:M2:M1,根据故答案为:M2:M1;
相同时,c与M成反比,即物质的量浓度比为:M2:M1,根据故答案为:M2:M1;
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是常温下浓硫酸具有强氧化性,会使铁钝化,起到防腐蚀作用,故答案为:常温下铁遇浓硫酸钝化;


科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符且正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO+4NH+2H2O
B.Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.水玻璃中通入少量的二氧化碳:Na2SiO3+CO2+H2O=2Na++CO32-+H2SiO3↓
D.少量SO2通入漂白粉溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
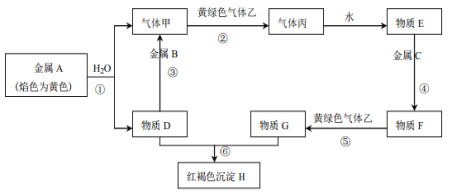
请回答下列问题:
(1)写出 B、乙的化学式:B_______________、乙_______________。
(2)写出下列反应的化学方程式:
反应⑤ ___________________________________________________________;
反应⑥____________________________________________________________。
(3)写出下列反应的离子方程式:
反应①___________________________________________________________;
反应③___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是________,D是________,G是________,H是________(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:_____________________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为__________________________。
(3)A中元素的原子结构示意图为________________。
(4)上述反应中属于氧化还原反应的是_________(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时将nmol·L-1氨水滴入10mLymol·L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示。下列有关说法不正确的是( )
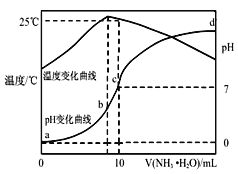
A.y=1.0
B.a点时Kw<1×10-14
C.b点c(NH4+)<c(Cl-)=![]() mol·L-1
mol·L-1
D.25℃时,NH4Cl的水解常数(Kh)可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A. CH2=CHCOOH、CH3COOCH=CH2均可作为合成聚合物的单体
B. C6Hn分子中的六个碳原子在同一直线上,则n可能等于2
C. 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同
D.  与
与 都是酚且互为同系物
都是酚且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物是重要的化工原料
(1)利用图所示装置及药品制取氨气。
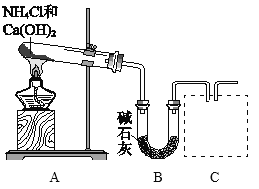
①A中制氨气的化学方程式是________。
②C处是用集气瓶收集氨气的装置,请绘出装置图。________
③证明氨气已集满的操作和现象是________。
(2)氨经催化氧化可制备硝酸,其过程中涉及如下反应。4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
①作为氧化剂的物质是______,氮元素的化合价______(填“升高”或“降低”)。
②若反应中消耗了4 mol NH3,则生成NO的物质的量为______ mol,转移电子的物质的量为______ mol。
(3)含氮废水会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:
![]()
请回答:
①过程Ⅲ发生化合反应的化学方程式为______。
②根据图1和图2,推断使用亚硝化菌的最佳条件为______。
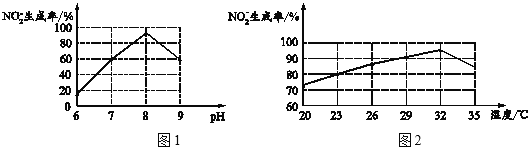
③利用微生物处理含氮废水的优点为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。
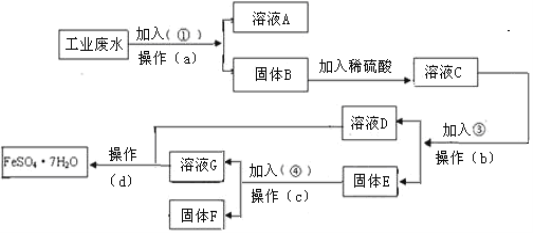
(1)若加入的试剂①为NaOH溶液,加入试剂①的目的___________________。
(2)操作a的名称为过滤、洗涤,所需要的玻璃仪器为烧杯、玻璃棒、_______。
(3)写出溶液C中加入试剂③发生反应的离子方程式为_______。
(4)写出固体E中加入试剂④发生反应的离子反应方程式为______________。
(5)从溶液D和溶液G中得到FeSO47H2O晶体的操作为蒸发浓缩、______、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com