
【题目】冶金工业、硝酸工业的废气废液中含氮化合物污染严重,必须处理达标后才能排放。
Ⅰ.用活性炭处理工厂尾气中的氮氧化物。
(1)已知:①4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH1=a kJ·mol1
②4NH3(g)+3O2(g) =2N2(g)+6H2O(l) ΔH2=b kJ·mol1
③C(s)+O2(g) =CO2(g) ΔH3=c kJ·mol1
则反应C(s)+2NO(g)![]() N2(g)+CO2(g)的ΔH=________。
N2(g)+CO2(g)的ΔH=________。
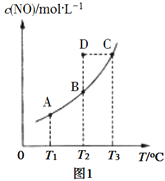
(2)在容积不变的密闭容器中,一定量的NO与足量的C发生反应:C(s)+2NO(g)![]() N2(g) + CO2(g) ΔH= Q kJ·mol1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是________。
N2(g) + CO2(g) ΔH= Q kJ·mol1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是________。
A.其他条件不变,改变活性炭的用量,平衡一定不移动
B.该反应的Q>0,所以T1、T2、T3对应的平衡常数:K1<K2<K3
C.温度为T2时,若反应体系处于状态D,则此时 υ(正)>υ(逆)
D.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)
(3)已知某温度时,反应C(s)+2NO(g)![]() N2(g)+CO2(g)的平衡常数K=
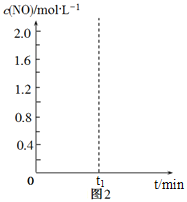
N2(g)+CO2(g)的平衡常数K=![]() ,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。_________________
,在该温度下的2L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。_________________
Ⅱ.用纳米铁粉或电解法处理废水中的硝酸盐。
(4)纳米铁粉处理污水中NO3的离子方程式为:4Fe+NO3–+10H+=4Fe2++NH4++3H2O。
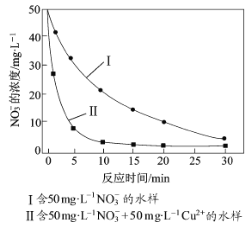
实验证实,pH偏低将会导致NO3的去除率下降,其原因是________________。相同条件下,纳米铁粉去除不同水样中NO3的速率有较大差异(见下图),产生该差异的可能原因是________________________。
(5)电解法处理水中硝酸盐的原理是:以金属Pt作电极,用质子交换膜把溶液分为阴阳两极区,阴极区为含硝酸盐的工业废水,接通直流电源进行电解,产物为N2。请写出阴极的电极反应式____________。
【答案】 (![]() +c)kJ/mol C
+c)kJ/mol C  纳米铁粉与H+反应生成H2,导致NO3-的去除率下降 Cu或Cu2+对纳米铁粉去除NO3-的反应有催化作用(或形成Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率) 2NO3-+10e-+12H+=N2↑+6H2O
纳米铁粉与H+反应生成H2,导致NO3-的去除率下降 Cu或Cu2+对纳米铁粉去除NO3-的反应有催化作用(或形成Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率) 2NO3-+10e-+12H+=N2↑+6H2O
【解析】I.(1)应用盖斯定律。
(2)A项,将C全部从平衡体系中移走,平衡逆向移动;B项,根据图像,升高温度c(NO)增大,平衡逆向移动,化学平衡常数减小,逆反应为吸热反应,Q![]() 0;C项,状态D的c(NO)大于T2平衡时c(NO),则状态D反应正向进行,此时υ(正)
0;C项,状态D的c(NO)大于T2平衡时c(NO),则状态D反应正向进行,此时υ(正)![]() υ(逆);D项,该反应的正反应为气体分子数不变的反应,气体分子物质的量始终不变,在容积不变的密闭容器中体系的压强取决于温度,温度越高压强越大,则p(C)
υ(逆);D项,该反应的正反应为气体分子数不变的反应,气体分子物质的量始终不变,在容积不变的密闭容器中体系的压强取决于温度,温度越高压强越大,则p(C)![]() p(B)=p(D)。
p(B)=p(D)。
(3)用三段式和化学平衡常数计算平衡时c(NO)。
II.(4)pH偏低,溶液酸性较强,纳米铁粉与H+反应生成H2,导致NO3-的去除率下降。根据图像,含Cu2+的水样中NO3-的去除速率更快,产生差异的原因是:Cu或Cu2+对纳米铁粉去除NO3-的反应有催化作用(或形成Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率)。
(5)根据题意,阴极NO3-得电子被还原成N2,2molNO3-得到10mol电子生成1molN2,结合质子交换膜和原子守恒书写。
I.(1)应用盖斯定律,将③-①![]() +②
+②![]() 得,C(s)+2NO(g)
得,C(s)+2NO(g)![]() N2(g)+CO2(g)ΔH=(c-
N2(g)+CO2(g)ΔH=(c-![]() +
+![]() )kJ/mol。
)kJ/mol。
(2)A项,将C全部从平衡体系中移走,平衡逆向移动,A项错误;B项,根据图像,升高温度c(NO)增大,平衡逆向移动,化学平衡常数减小,逆反应为吸热反应,Q![]() 0且K1
0且K1![]() K2
K2![]() K3,B项错误;C项,状态D的c(NO)大于T2平衡时c(NO),则状态D反应正向进行,此时υ(正)
K3,B项错误;C项,状态D的c(NO)大于T2平衡时c(NO),则状态D反应正向进行,此时υ(正)![]() υ(逆),C项正确;D项,该反应的正反应为气体分子数不变的反应,气体分子物质的量始终不变,在容积不变的密闭容器中体系的压强取决于温度,温度越高压强越大,则p(C)
υ(逆),C项正确;D项,该反应的正反应为气体分子数不变的反应,气体分子物质的量始终不变,在容积不变的密闭容器中体系的压强取决于温度,温度越高压强越大,则p(C)![]() p(B)=p(D),D项错误;答案选C。
p(B)=p(D),D项错误;答案选C。
(3)用三段式,设从起始到平衡转化c(NO)为xmol/L
C(s)+2NO(g)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
c(起始)(mol/L) 1.0 0 0
c(转化)(mol/L) x ![]()
![]()
c(平衡)(mol/L) 1.0-x ![]()
![]()
化学平衡常数K=![]() =
=![]() =
=![]() ,解得x=0.6,作图时,起始c(NO)为1.0mol/L,随着时间推移c(NO)减小,t1达到平衡时c(NO)为1.0mol/L-0.6mol/L=0.4mol/L,t1后c(NO)保持0.4mol/L。
,解得x=0.6,作图时,起始c(NO)为1.0mol/L,随着时间推移c(NO)减小,t1达到平衡时c(NO)为1.0mol/L-0.6mol/L=0.4mol/L,t1后c(NO)保持0.4mol/L。
II.(4)pH偏低,溶液酸性较强,纳米铁粉与H+反应生成H2,导致NO3-的去除率下降。根据图像,含Cu2+的水样中NO3-的去除速率更快,产生差异的原因是:Cu(Fe与Cu2+反应生成Cu,反应的方程式为Fe+Cu2+=Fe2++Cu)或Cu2+对纳米铁粉去除NO3-的反应有催化作用(或形成Fe-Cu原电池增大纳米铁粉去除NO3-的反应速率)。
(5)根据题意,阴极NO3-得电子被还原成N2,2molNO3-得到10mol电子生成1molN2,结合质子交换膜和原子守恒,阴极的电极反应式为2NO3-+10e-+12H+=N2↑+6H2O。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】下图中A~H均为中学化学中常见的物质,A是黄绿色气体、B、H是无色无味气体。(反应中生成的水已略去)

请回答以下问题:
(1)A是________,H是________。(填化学式)
(2)C物质在日常生活中可作________剂。
(3)F分子所含共价键类型是________;写出B的电子式_________。
(4)写出反应①的化学方程式:____________________________;写出反应③的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰在生活和化学实验中有广泛应用。海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:

(1)步骤Ⅰ中,试剂甲必须具有的性质是________(填序号)。
A.碱性 B.稳定性 C.氧化性 D.还原性
(2)用惰性材料作电极,电解硫酸锰溶液制二氧化锰,写出阳极反应式:_____________________。步骤Ⅲ中,以KClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的KClO3溶液200 mL,该反应的离子方程式为____________________________________________。
(3)用100 mL 12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气在标准状况下体积范围为________________。工业上可以用实验室制氯气的残余物质溶液吸收氯气,获得Mn2O3,Mn2O3广泛应用于电子工业、印染工业等领域。请写出该化学反应的离子方程式:__________________。
(4)二氧化锰是实验室制取氧气的催化剂。下列是某同学设计实验探究双氧水分解实验方案;
实验 | 20.0 mL双氧水溶液浓度 | 粉状MnO2 | 温度 | 待测数据 |
Ⅰ | 5% | 2.0 g | 20℃ | |
Ⅱ | 5% | 1.0 g | 20℃ | |
Ⅲ | 10% | 1.0 g | 20℃ | |
Ⅳ | ω | 2.0 g | 30℃ |
①实验Ⅱ和Ⅲ的结论是____________________________________________________。
②利用实验Ⅰ和Ⅳ探究温度对化学反应速率的影响,w=________。本实验待测数据是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下均能通过一步反应实现的是
A. NaAlO2(aq) AlCl3
AlCl3![]() Al2O3B. NaCl(饱和)
Al2O3B. NaCl(饱和)![]() NaHCO3
NaHCO3![]() Na2CO3C. N2
Na2CO3C. N2 NO2
NO2![]() HNO3
HNO3
D. FeS2![]() SO3
SO3![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据凤凰网2018 年2 月1日报道:中科院研发出世界最强氘氚中子源,下列有关说法正确的是
A. 氘、氚是两种不同的元素 B. 氘、氚的中子数分别为1、2
C. 氘、氚核外电子数不同 D. 中子带正电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,在周期表中所处的位置如下图所示。A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:
A | C | |
D | B | E |
(1)写出三种元素名称A________、B _______、C_______。
(2)B元素位于元素周期表中第______周期,_______族。
(3)比较B、D、E三种元素的最高价氧化物的水化物酸性最强的是(用化学式表示)______。
(4)C原子结构示意图为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A.异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为__________________,As基态原子核外有____个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是___________,Ga、As、Se的电负性由大到小的顺序是_________________。
(3)比较下列镓的卤化物的熔点和佛点,分析其变化规律及原因:_________________。
镓的卤化物 | GaI3 | GaBr3 | GaCl3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是______________。
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为___________,草酸根中碳原子的杂化轨道类型为______________。

(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为_____g/cm3(设NA为阿伏加德罗常数的值,列出计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com